關鍵詞:5G,TIM, EMI ,EMC, ESD, 絕緣,透波,高導熱,國產高端新材料
導語:隨著電子設備的性能和功能的提高,每個設備產生的熱量增加,熱量有效地散發、消散和冷卻熱量很重要。對于5G智能手機和AR/VR設備等高性能移動產品,由于采用高性能IC和追求減輕重量的高度集成設計,導致散熱部件的安裝空間受到限制,因此利用高導熱墊片和導熱凝膠等TIM材料來更好地散熱。
什么是氮化硼?

氮化硼是由氮原子和硼原子所構成的晶體。化學組成為43.6%的硼和56.4%的氮,具有四種不同的變體:六方氮化硼(HBN)、菱方氮化硼(RBN)、立方氮化硼(CBN)和纖鋅礦氮化硼(WBN)。

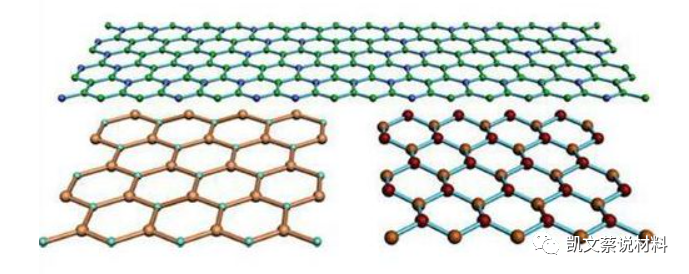
氮化硼問世于100多年前,最早的應用是作為高溫潤滑劑的六方氮化硼,不僅其結構而且其性能也與石墨極為相似,且自身潔白,所以俗稱:白石墨。
氮化硼(BN)陶瓷是早在1842年被人發現的化合物。國外對BN材料從第二次世界大戰后進行了大量的研究工作,直到1955年解決了BN熱壓方法后才發展起來的。美國金剛石公司和聯合碳公司首先投入了生產,1960年已生產10噸以上。
1957年R·H·Wentrof率先試制成功CBN,1969年美國通用電氣公司以商品Borazon銷售,1973年美國宣布制成CBN刀具。
1975年日本從美國引進技術也制備了CBN刀具。
1979年首次成功采用脈沖等離子體技術在低溫低壓卜制備崩c—BN薄膜。
20世紀90年代末,人們已能夠運用多種物理氣相沉積(PVD)和化學氣相沉積(CVD)的方法制備c-BN薄膜。
從中國國內看,發展突飛猛進,1963年開始BN粉末的研究,1966年研制成功,1967年投入生產并應用于我國工業和尖端技術之中。

物質特性
CBN通常為黑色、棕色或暗紅色晶體,為閃鋅礦結構,具有良好的導熱性。硬度僅次于金剛石,是一種超硬材料,常用作刀具材料和磨料。
氮化硼具有抗化學侵蝕性質,不被無機酸和水侵蝕。在熱濃堿中硼氮鍵被斷開。1200℃以上開始在空氣中氧化。真空時約2700℃開始分解。微溶于熱酸,不溶于冷水,相對密度2.29。壓縮強度為170MPa。在氧化氣氛下最高使用溫度為900℃,而在非活性還原氣氛下可達2800℃,但在常溫下潤滑性能較差。氮化硼的大部分性能比碳素材料更優。對于六方氮化硼:摩擦系數很低、高溫穩定性很好、耐熱震性很好、強度很高、導熱系數很高、膨脹系數較低、電阻率很大、耐腐蝕、可透微波或透紅外線。

物質結構
氮化硼六方晶系結晶,最常見為石墨晶格,也有無定形變體,除了六方晶型以外,氮化硼還有其他晶型,包括:菱方氮化硼(r-BN)、立方氮化硼(c-BN)、纖鋅礦型氮化硼(w-BN)。人們甚至還發現像石墨稀一樣的二維氮化硼晶體。
通常制得的氮化硼是石墨型結構,俗稱為白色石墨。另一種是金剛石型,和石墨轉變為金剛石的原理類似,石墨型氮化硼在高溫(1800℃)、高壓(8000Mpa)[5~18GPa]下可轉變為金剛型氮化硼。是新型耐高溫的超硬材料,用于制作鉆頭、磨具和切割工具。

應用領域
1. 金屬成型的脫模劑和金屬拉絲的潤滑劑。
2. 高溫狀態的特殊電解、電阻材料。
3. 高溫固體潤滑劑,擠壓抗磨添加劑,生產陶瓷復合材料的添加劑,耐火材料和抗氧化添加劑,尤其抗熔融金屬腐蝕的場合,熱增強添加劑、耐高溫的絕緣材料。
5. 壓制成各種形狀的氮化硼制品,可用做高溫、高壓、絕緣、散熱部件。
6. 航天航空中的熱屏蔽材料。
7. 在觸媒參與下,經高溫高壓處理可轉化為堅硬如金剛石的立方氮化硼。
8. 原子反應堆的結構材料。
9. 飛機、火箭發動機的噴口。
10.高壓高頻電及等離子弧的絕緣體。
11.防止中子輻射的包裝材料。
12.由氮化硼加工制成的超硬材料,可制成高速切割工具和地質勘探、石油鉆探的鉆頭。
13.冶金上用于連續鑄鋼的分離環,非晶態鐵的流槽口,連續鑄鋁的脫模劑。
14.做各種電容器薄膜鍍鋁、顯像管鍍鋁、顯示器鍍鋁等的蒸發舟。
15.各種保鮮鍍鋁包裝袋等。
16.各種激光防偽鍍鋁、商標燙金材料,各種煙標,啤酒標、包裝盒,香煙包裝盒鍍鋁等等。
17.化妝品用于口紅的填料,無毒又有潤滑性,又有光澤。

未來前景
由于鋼鐵材料硬度很高,因而加工時會產生大量的熱,金剛石工具在高溫下易分解,且容易與過渡金屬反應,而c-BN材料熱穩定性好,且不易與鐵族金屬或合金發生反應,可廣泛應用于鋼鐵制品的精密加工、研磨等。c-BN除具有優良的耐磨性能外,耐熱性能也極為優良,在相當高的切削溫度下也能切削耐熱鋼、鐵合金、淬火鋼等,并且能切削高硬度的冷硬軋輥、滲碳淬火材料以及對刀具磨損非常嚴重的Si-Al合金等。實際上,由c-BN晶體(高溫高壓合成)的燒結體做成的刀具、磨具已應用于各種硬質合金材料的高速精密加工中。
c-BN作為一種寬禁帶(帶隙6.4 eV)半導體材料,具有高熱導率、高電阻率、高遷移率、低介電常數、高擊穿電場、能實現雙型摻雜且具有良好的穩定性,它與金剛石、SiC和GaN一起被稱為繼Si、Ge及GaAs之后的第三代半導體材料,它們的共同特點是帶隙寬,適用于制作在極端條件下使用的電子器件。與SiC和GaN相比,c-BN與金剛石有著更為優異的性質,如更寬的帶隙、更高的遷移率、更高的擊穿電場、更低的介電常數和更高的熱導率。顯然作為極端電子學材料,c-BN與金剛石更勝一籌。然而作為半導體材料金剛石有它致命的弱點,即金剛石的n型摻雜十分困難(其n型摻雜的電阻率只能達到102Ω·cm,遠遠未達到器件標準),而c-BN則可以實現雙型摻雜。例如,在高溫高壓合成以及薄膜制備過程中,添加Be可得到P型半導體;添加S、C、Si等可得到n型半導體。因此綜合看來c-BN是性能最為優異的第三代半導體材料,不僅能用于制備在高溫、高頻、大功率等極端條件下工作的電子器件,而且在深紫外發光和探測器方面有著廣泛的應用前景。事實上,最早報道了在高溫高壓條件下制成的c-BN發光二極管,可在650℃的溫度下工作,在正向偏壓下二極管發出肉眼可見的藍光,光譜測量表明其最短波長為215 nm(5.8 eV)。c-BN具有和GaAs、Si相近的熱膨脹系數,高的熱導率和低的介電常數,絕緣性能好,化學穩定性好,使它成為集成電路的熱沉材料和絕緣涂覆層。此外c-BN具有負的電子親和勢,可以用于冷陰極場發射材料,在大面積平板顯示領域具有廣泛的應用前景。
在光學應用方面,由于c-BN薄膜硬度高,并且從紫外(約從200 nm開始)到遠紅外整個波段都具有高的透過率,因此適合作為一些光學元件的表面涂層,特別適合作為硒化鋅(ZnSe)、硫化鋅(ZnS)等窗口材料的涂層。此外,它具有良好的抗熱沖擊性能和商硬度,有望成為大功率激光器和探測器的理想窗窗口材料。
什么是氧化鋁?

氧化鋁(aluminium oxide)是一種無機物,化學式Al2O3,是一種高硬度的化合物,熔點為2054℃,沸點為2980℃,在高溫下可電離的離子晶體,常用于制造耐火材料。
工業氧化鋁是由鋁礬土(Al2O3·3H2O)和硬水鋁石制備的,對于純度要求高的Al2O3,一般用化學方法制備。Al2O3有許多同質異晶體,已知的有10多種,主要有3種晶型,即α-Al2O3、β-Al2O3、γ-Al2O3。其中結構不同性質也不同,在1300℃以上的高溫時幾乎完全轉化為α-Al2O3。

氧化鋁是鋁的穩定氧化物,化學式為Al2O3。在礦業、制陶業和材料科學上又被稱為礬土。
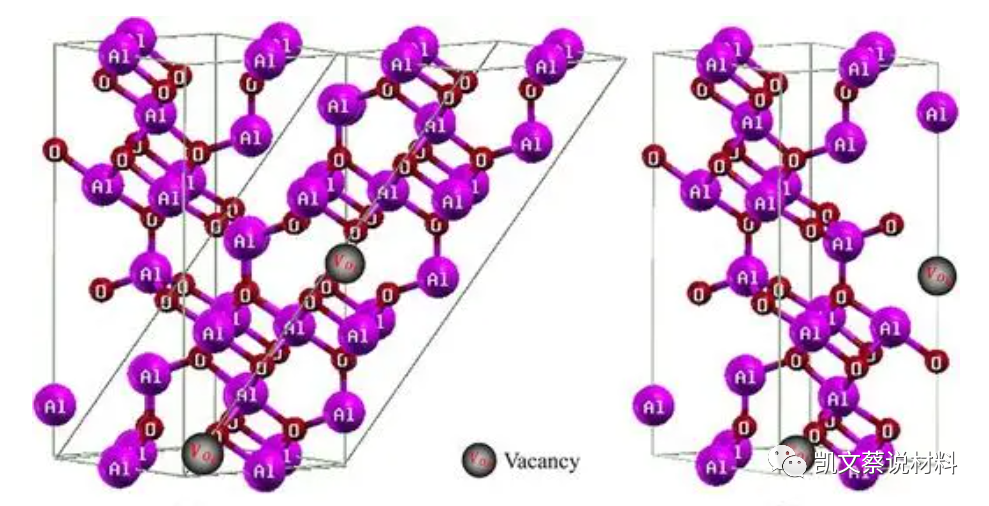
分子結構圖
性狀:難溶于水的白色固體,無臭、無味、質極硬,易吸潮而不潮解(灼燒過的不吸濕)。氧化鋁是典型的兩性氧化物(剛玉是α形屬于六方最密堆積,是惰性化合物,微溶于酸堿耐腐蝕[1]),能溶于無機酸和堿性溶液中,幾乎不溶于水及非極性有機溶劑;相對密度(d204)4.0;熔點2050℃。
儲存:密封干燥保存。
用途:用作分析試劑、有機溶劑的脫水、吸附劑、有機反應催化劑、研磨劑、拋光劑、冶煉鋁的原料、耐火材料。

氧化鋁含有元素鋁和氧。若將鋁礬土原料經過化學處理,除去硅、鐵、鈦等的氧化物而制得的產物是純度很高的氧化鋁原料,Al2O3含量一般在99%以上。礦相是由40%~76%的γ- Al2O3和24%~60%的α- Al2O3組成。γ- Al2O3于950~1200℃可轉變為α- Al2O3,同時發生顯著的體積收縮。
什么是氫氧化鋁?

氫氧化鋁是一種無機物,化學式Al(OH)3,是鋁的氫氧化物。氫氧化鋁既能與酸反應生成鹽和水又能與強堿反應生成鹽和水,因此它是一種兩性氫氧化物。由于又顯一定的酸性,所以又可稱之為鋁酸(H3AlO3)。但實際與堿反應時生成的是四羥基合鋁酸鹽([Al(OH)4]-)。因此通常在把它視作一水合偏鋁酸(HAlO2·H2O),按用途分為工業級和醫藥級兩種。


基本性質
CAS號:21645-51-2
分子式:Al(OH)3
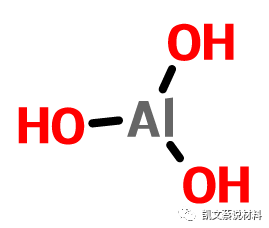
分子量:78.004
精確質量:77.98980
PSA:60.69000。
物化性質
外觀與性狀:白色非晶形的粉末
密度:2.40g/cm3
熔點:300℃
水溶解性:不溶
儲存條件:庫房通風低溫干燥
氫氧化鋁與酸反應:Al(OH)3+3HCl → AlCl3+3H2O
Al(OH)3+3H+→Al3++3H2O
氫氧化鋁與堿反應:Al(OH)3+NaOH → Na[Al(OH)4]
氫氧化鋁在堿性環境中異構反應:Al(OH)3→HAlO2+H2O
Al(OH)3+OH-→AlO2-+2H2O
氫氧化鋁受熱分解:

氫氧化鋁水中兩種電離:
1、Al(OH)3?Al3++ 3OH-(堿式電離)
2、Al(OH)3+H2O?[Al(OH)4]-+H+(酸式電離)
其中的[Al(OH)4]-中學上習慣寫成AlO2-,但是實際上這是錯誤的。
一般所謂的氫氧化鋁實際上是指三氧化二鋁的水合物。如向鋁鹽溶液中加入氨水或弱堿而得到的白色膠狀沉淀,其含水量不定,組成也不均勻,統稱為水合氧化鋁。只有在鋁酸鹽溶液中(含有Al(OH)4-離子)的溶液中通CO2才可得到真正的氫氧化鋁。
結晶的氫氧化鋁與水合氧化鋁不同,難溶于酸,加熱到373K也不脫水,在573K加熱2h才能轉變為偏氫氧化鋁AlO(OH)。
氫氧化鋁屬兩性氫氧化物。由于其存在兩種電離形式,既是弱酸,可以有酸式化學式H3AlO3,又是弱堿,可以有堿式化學式Al(OH)3。氫氧化鋁具有兩性,既能與酸反應又能與堿反應。
氫氧化鋁的酸性在于它是路易斯酸可以加合OH-,從而體現堿性
Al(OH)3由于兩種電離的存在,可以產生兩種鹽:鋁鹽和偏鋁酸鹽:
⒈鋁鹽:AlCl3、KAl(SO4)2·12H2O(明礬),它們的水溶液因Al3+的水解而顯酸性
2.偏鋁酸鹽,NaAlO2、KAlO2,它們的水溶液呈堿性:AlO-+ 2H2O → Al(OH)3+ OH-當兩類鹽混合時,即發生雙水解反應,生成 Al(OH)3。
Al3++ 3 AlO-+ 6H2O = 4Al(OH)3↓
氫氧化鋁主要有325目、800目、1250目、5000目四個規格。白色粉末狀固體。幾乎不溶于水,能凝聚水中的懸浮物,吸附色素。

氫氧化鋁是用量最大和應用最廣的無機阻燃添加劑。氫氧化鋁作為阻燃劑不僅能阻燃,而且可以防止發煙、不產生滴下物、不產生有毒氣體,因此,獲得較廣泛的應用,使用量也在逐年增加。使用范圍:熱固性塑料、熱塑性塑料、合成橡膠、涂料及建材等行業。同時,氫氧化鋁也是電解鋁行業所必需氟化鋁的基礎原料,在該行業氫氧化鋁也是得到非常廣泛應用。
高端氮化硼-氧化鋁-氫氧化鋁
一
氮化硼


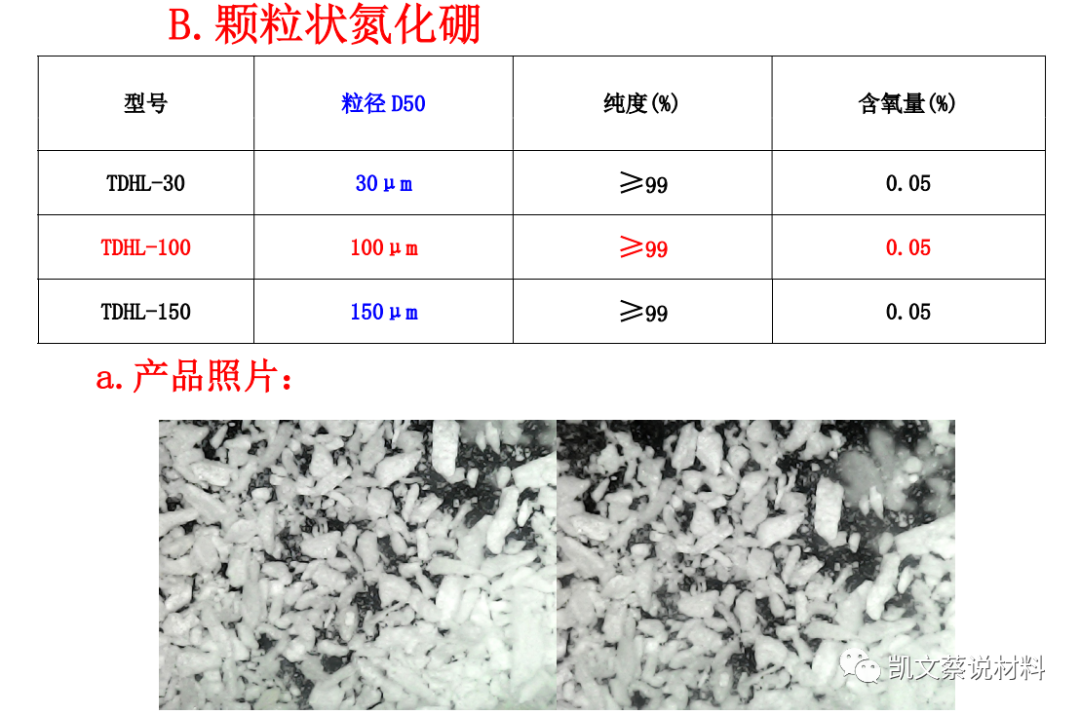
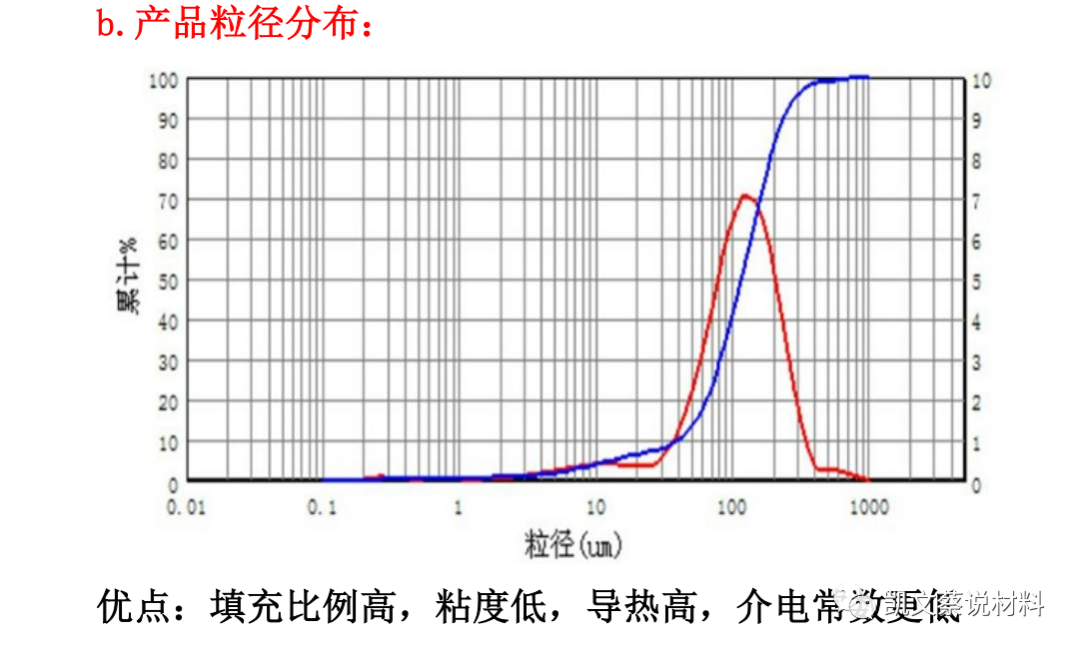
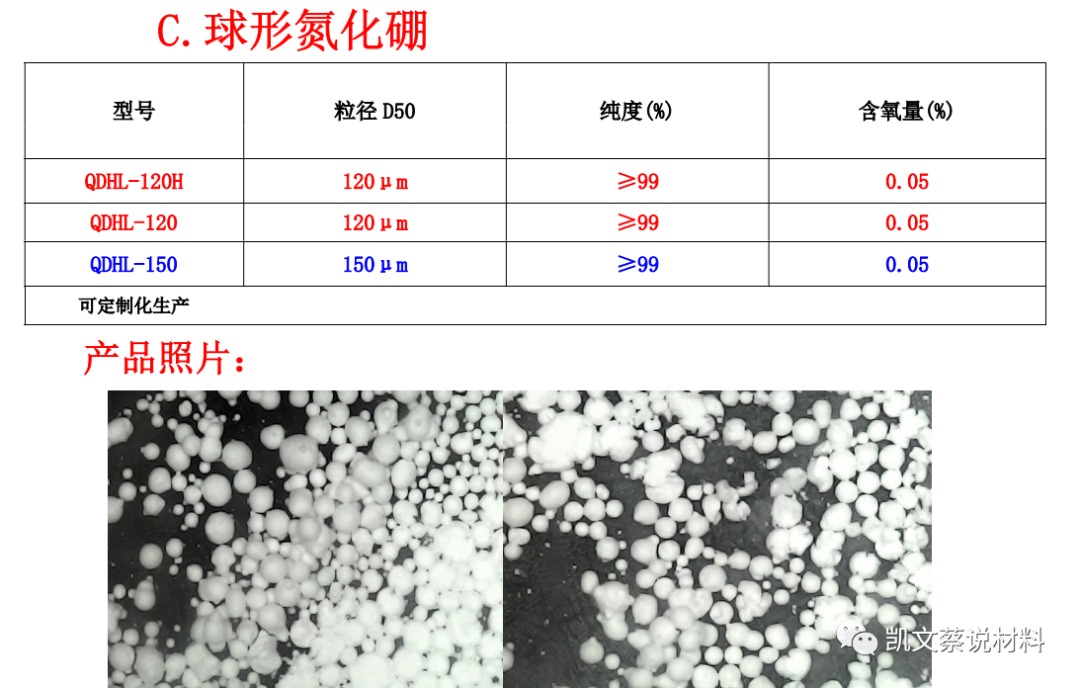

二
氧化鋁
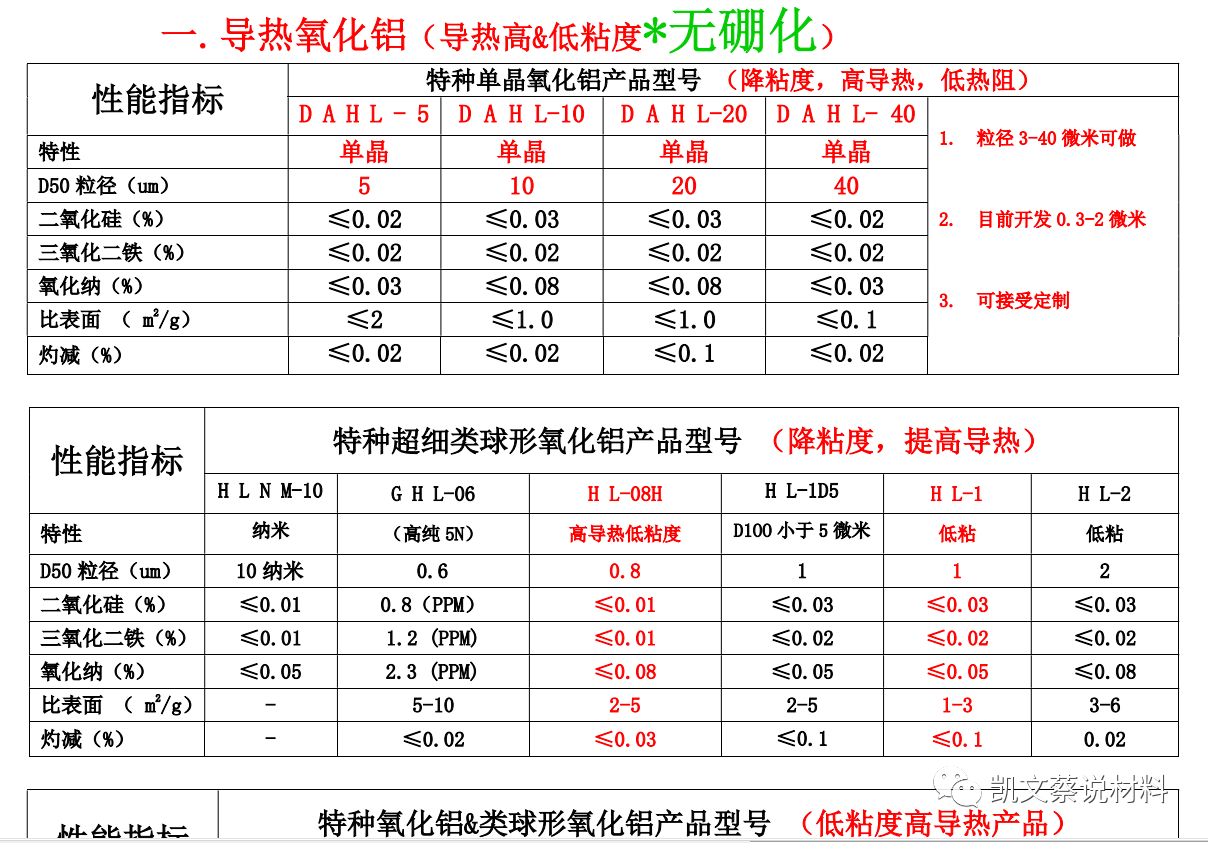
1、導熱氧化鋁
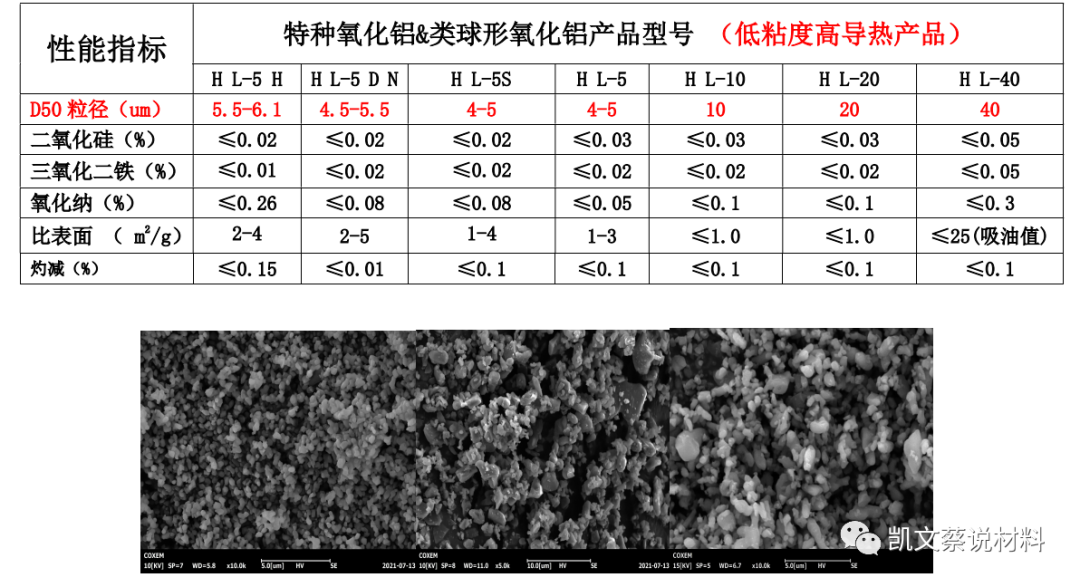
2、球形氧化鋁
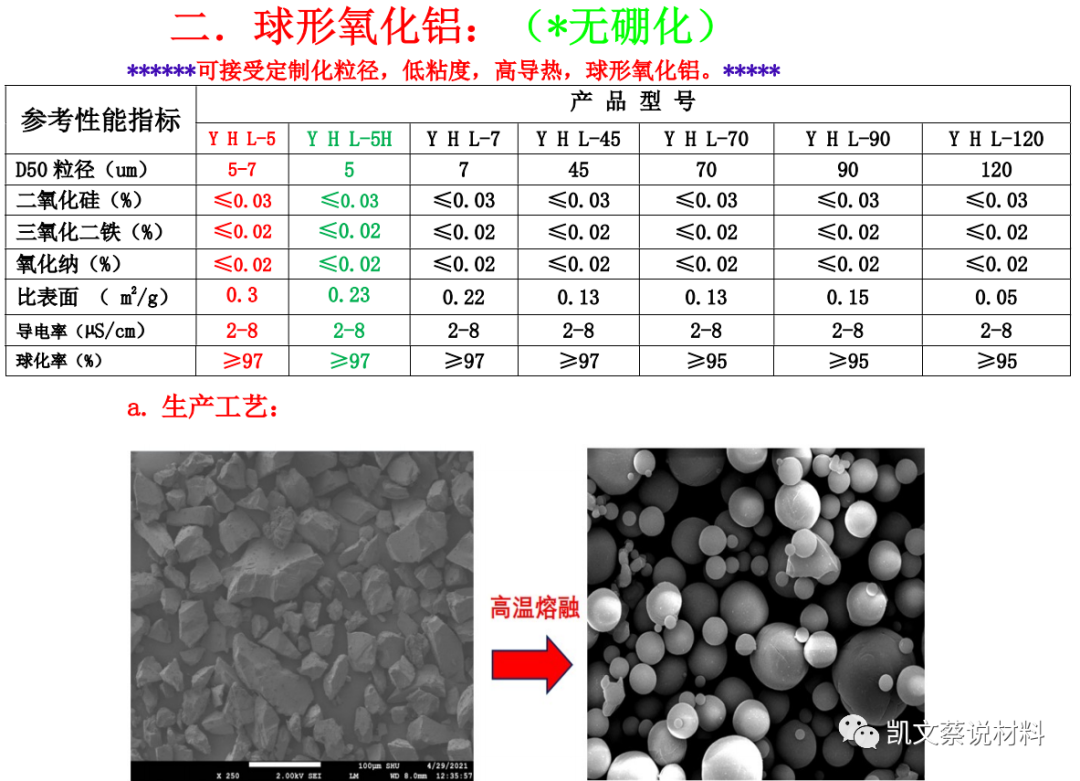

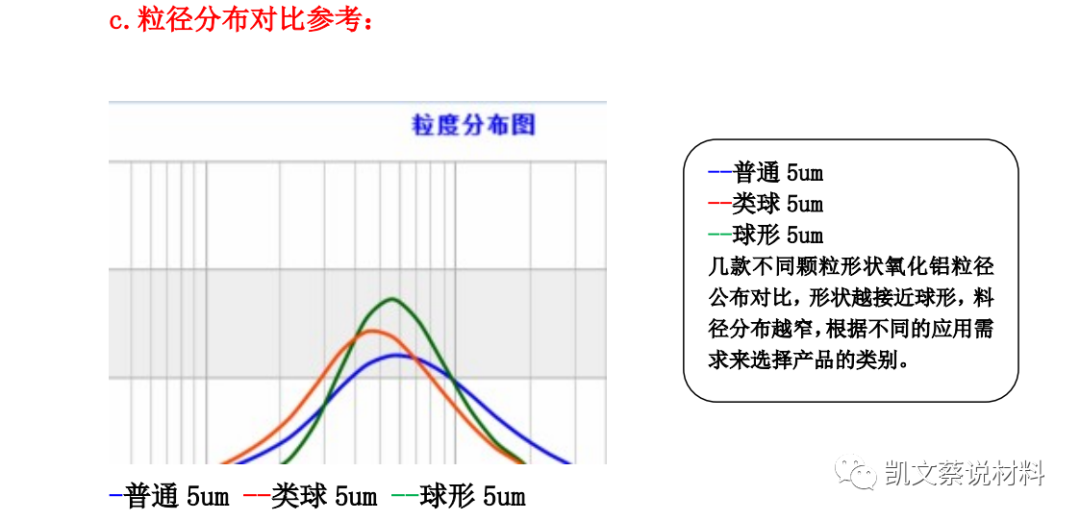

三
氫氧化鋁

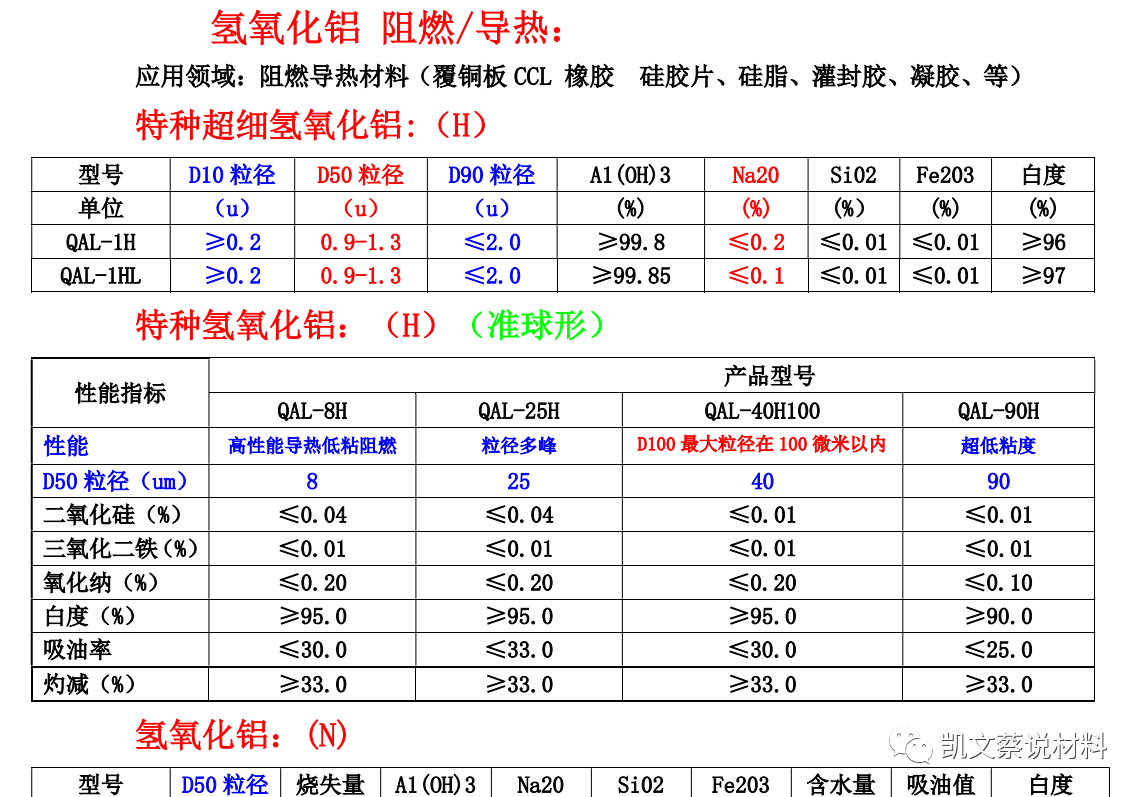

-
emi
+關注
關注
53文章
3602瀏覽量
127987
發布評論請先 登錄
相關推薦
導熱氧化鋁粉(DCA-S)增強鋰電池散熱性能的機理與效果分析
高導熱高絕緣低介電材料 | 氮化硼散熱膜

華清電子擬在重慶建設半導體封裝材料和集成電路先進陶瓷生產基地
氧化鋁隔斷粉在氧化鋁陶瓷基板的應用

東超新材:球形氧化鋁粉在新能源電池導熱材料中的應用

高絕緣散熱材料 | 石墨片氮化硼散熱膜復合材料

汽車ADAS系統高效散熱,球形氧化鋁導熱粉體解決方案
EAK陶瓷電阻器-無感碳電阻
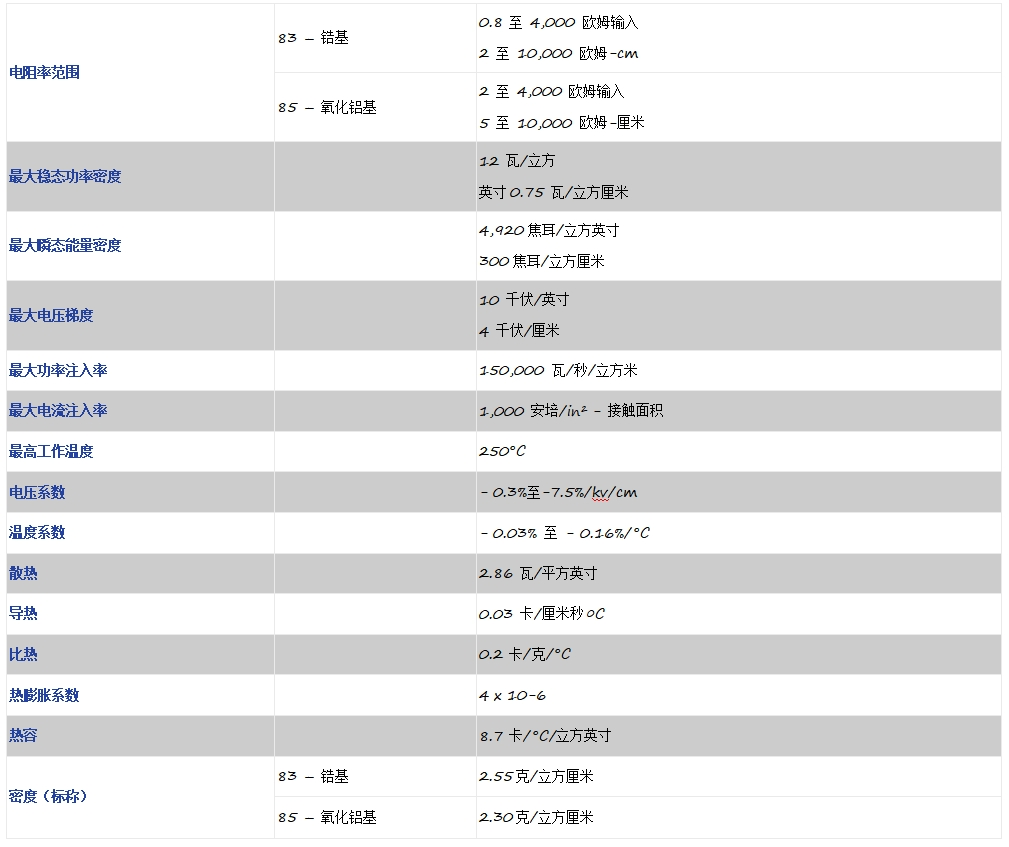
氮化鋁AlN電阻器-厚膜AlN電阻

5G時代下,無機填料氧化鋁導熱粉在覆銅板市場的發展趨勢與重要性
氮化鋁與氧化鈹用于大功率電阻器產品
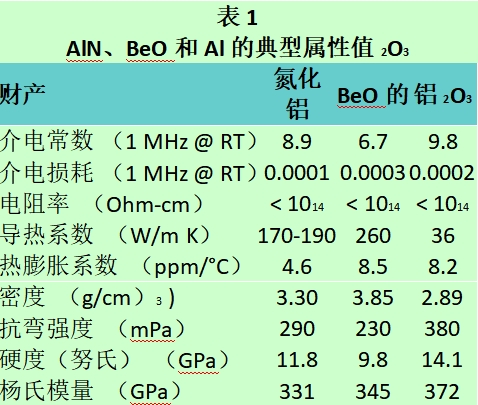




 高端粉體材料氮化硼-氧化鋁-氫氧化鋁介紹
高端粉體材料氮化硼-氧化鋁-氫氧化鋁介紹











評論