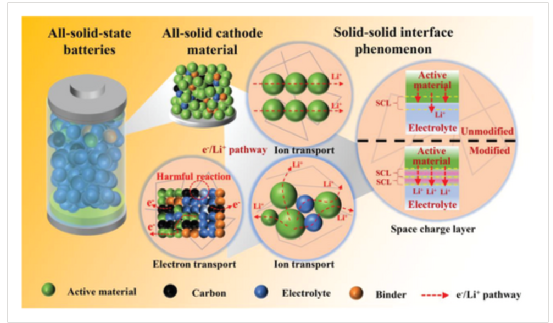
界面和電極串擾決定了固態電池的熱穩定性
隨著鋰離子電池(LIBs)接近其理論能量密度,它們面臨著有關安全和耐久性的挑戰。由于鋰(Li)金屬陽極的低電化學電位(與標準氫電極相比為-3.04V)、高比容量(3860 mAhg–1?)和低密度,利用它們是提高鋰離子電池能量密度的一個有希望的方法。
然而,金屬鋰的高反應性,導致枝晶生長和內部短路,仍然是一個主要的安全問題,大多數液體電解質的可燃性加劇了這一問題。在這方面,使用不易燃的無機固體電解質(SE)的固態電池(SSBs)的發展被認為是實現鋰金屬陽極和改善熱安全性的重要一步。盡管有SE的前景,但在廣泛的SSB系統中觀察到的金屬鋰的形態不穩定。例如,Li7La3Zr2O12(LLZO)、Li6PS5Cl(LPSCl)、Li3PS4(LPS)一直面臨瓶頸。
為了了解鋰枝晶的起源,各種可能機制,包括界面接觸的喪失,晶界和表面缺陷已經被探測到。此外,在與金屬鋰接觸時,基于氧化物和硫化物的SE的熱力學不穩定性質會導致界面的形成。界面生長已被確定為SEs的一個關鍵失效機制,如Li1.4Al0.4Ge1.6(PO4?)?3(LAGP)和Li10SnP2S12(LSPS) 。
雖然主要重點放在電化學機械、形態學和傳輸限制上, SSB的熱安全性,已經被最近的一些研究提請注意,仍然需要進行嚴格的調查。除了不可燃性轉化為熱安全性的傳統觀念外,還需要建立固-固界面的電化學/化學特性與其熱穩定性之間的基本映射關系。
金屬鋰的高反應性和低熔點,加上SE/Li界面的電化學演變(例如,界面生長)是在熱安全方面仍需審視的關鍵方面。SSB的熱穩定性有可能取決于內在固-固界面上發生的不同的電化學相互作用和降解過程。此外,濫用情況,如外部加熱和內部短路(例如,由于鋰絲穿透),這涉及到電化學能量轉換為熱量,可能會導致內部溫度升高。
因此,對于給定的電極和電解質材料的組合,當務之急是量化臨界溫度極限,超過這個極限,SSB就會發生熱失控。認識到潛在的機理相互作用,材料層面和電池層面的熱穩定性之間的差距也應該被彌合。
【工作介紹】
本工作研究了三種廣泛使用的硫化物電解質,即LPS、LPSCl和LSPS與金屬Li之間的界面特性和熱穩定性之間的基本關聯。使用加速率量熱法(ARC)研究它們的熱穩定性,雖然LPS/Li和LPSCl/Li界面在電化學循環前后表現出類似的放熱行為,但LSPS/Li界面卻表現出明顯不同的反應。
即使在未循環狀態下,LSPS/Li界面也會發生熱失控,并且在循環后明顯加劇,這伴隨著在Li熔點附近出現的巨大熱峰值。X射線光電子能譜(XPS)分析揭示了熱失控開始的這種轉變與涉及金屬錫形成的LSPS界面的演變之間的獨特聯系。

此外,開發了一個計算模型,在觀察到的材料級反應的基礎上捕捉到電池級的熱穩定性,并劃定了作為界面/鋰相互作用、陰極/鋰串擾和特定能量函數的安全制度圖。分析表明,雖然SSBs需要比LIBs更大的溫度才能發生熱失控,但超過這個限度,它們就會出現嚴重的自熱率和溫度上升。隨著SSB的研究繼續揭開界面退化的各種模式,本研究強調了同時評估其對安全的影響的關鍵需要。
【具體內容】
熱力學上穩定且無反應的SE/Li界面不涉及固體電解質界面(SEI)的形成。然而,大多數SE與金屬鋰在熱力學上是不穩定的,這導致了SE的分解和界面的形成。當界面表現出可忽略的電子傳導性和足夠的離子傳導性時,它在動力學上是自限的(圖1a,b)。
然而,離子-電子混合導電界面(MCI)的形成會導致界面持續增長(圖1a,c)。在進行熱穩定性分析之前,研究了對稱的Li/SE/Li(SE=LPS,LPSCl,LSPS)電池的電化學反應。對稱電池在0.1 mAcm–2?,總容量為10 mAh cm–2?。在0.1 mAcm–2?,Li/LPS/Li電池顯示出相對穩定的循環,持續時間為100小時,每次循環的過電位沒有明顯變化(圖1d,e)。沿著Li/LPSCl/Li電池的類似路線,每個周期的過電位趨勢幾乎保持不變(圖1f)。由于界面接觸的喪失,在每個半周期內觀察到電池極化的增加~5 mV(圖1g)。
相比之下,Li/LSPS/Li電池在20小時內顯示出0.8V的過電位增加,100小時后為2.7V(圖1h,i)。循環前后的EIS光譜的比較表明了一個明顯的阻抗上升(圖1j)。循環中阻抗的增加可能是由于在LSPS/Li界面的界面生長,這導致了離子傳輸的額外阻力。
與此相關,LSPS/Li界面上活性接觸的喪失也可能是阻抗上升的一個因素。空隙的形成會增加界面上的反應過電位和傳輸阻力。LPS/LPSCl/LSPS電池之間的過電位特征的差異表明,雖然LPS和LPSCl可以涉及動力學穩定的界面,但LSPS表現出漸進的界面增長。
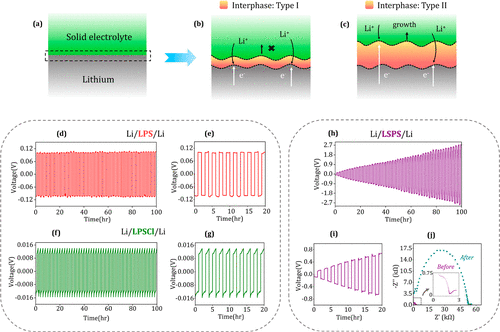
圖1.Li/SE/Li系統的電化學反應。(a)SE/Li界面可以涉及以下類型的界面:(b)動力學上的自限性界面和(c)離子-電子混合導電界面。(d)Li/LPS/Li、(f)Li/LPSCl/Li和(h)Li/LSPS/Li電池在0.1 mAcm–2?(總容量=10 mAh cm–2?)的恒流循環。(e,g,i) 放大圖顯示了循環早期階段的過電位特征。(j) 循環前后Li/LSPS/Li電池的阻抗光譜。
在ARC測試中,使用加熱-等待-尋找(HWS)方法,將樣品以5℃的增量加熱到400℃。在HWS過程中,初始溫度為50℃,在各溫度增量之間使用20分鐘的等待時間。在等待步驟之后,如果在尋求步驟中發現由于自熱而導致的溫度上升(dT/dt)大于0.02 °C/min,ARC試驗室將切換到絕熱模式,并跟蹤樣品溫度的上升,直到達到最高溫度限制。
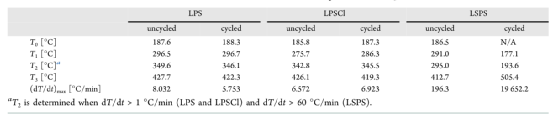
熱反應是以四個特征溫度來量化的,其中包括Li熔化后出現第一個放熱的溫度(T0?),由于自熱而出現的連續放熱的起始溫度(T1?),熱失控的起始溫度(T2?),以及樣品達到的最高溫度(T3?)。每個樣品由四個具有相同電化學性能的電池組成,以獲得ARC測試中檢測放熱所需的熱質量。
通過這一分析,目標是回答兩個問題:(1)在未循環狀態下,LPS、LPSCl和LSPS與金屬鋰的界面是否會發生熱失控?2)電化學循環或降解(例如,由于界面生長)是否會改變界面的熱穩定性?
如圖2a所示,未循環的LPS樣品在296.5℃時顯示出自熱開始(T1?),在349.6℃時出現放熱(T2?)。超過這個極限,自熱速率有相當大的增加(高達8.032 °C/min),這導致放熱和最高溫度為427.7 °C(圖2a,b)。在Li熔化后,循環的和未循環的樣品之間引發了熱反應的小變化。
然而,與未循環的樣品相比,循環的LPS樣品在特征溫度和(dT/dt)方面幾乎沒有變化max?,這在表1中進行了總結。同樣,在LPSCl的情況下,未循環的樣品在185.8和275.7°C表現出兩個主要的放熱現象,如圖2c所示。在循環和未循環的LPSCl樣品之間,沒有觀察到特征溫度和自熱率的明顯變化(圖2c,d)。
有趣的是,即使在LPS和LPSCl的情況下,也只檢測到熱反應的小差異(表1)。較小的放熱(在185和190℃之間)可能是由于熔融鋰和界面產物之間的反應,而較大的放熱(在275和300℃之間)可能對應于界面的熱分解及其隨后與熔融鋰的反應。
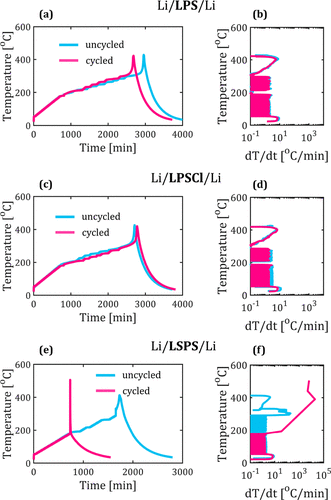
圖2.探究SE/Li界面的熱穩定性的ARC實驗。(a)Li/LPS/Li,(c)Li/LPSCl/Li, 和(e)Li/LSPS/Li 對稱電池在電化學循環前后的溫度響應。(b)Li/LPS/Li、(d)Li/LPSCl/Li和(f)Li/LSPS/Li情況下的溫度上升和相應的自熱率。在循環后的LSPS/Li界面上觀察到了一個急劇上升的自熱率和一個由此產生的熱失控起始點的轉變。
表1.通過ARC實驗量化的SE/Li界面的熱特性
 ?
?
與LPS和LPSCl的情況相比,即使對于未循環的LSPS樣品,也觀察到了截然不同的放熱反應,它在295℃時表現出一個大的熱峰值(圖2e)。檢測到一個明顯較高的自熱速率(高達196.3 °C/min),這導致了熱失控和最高溫度412.7 °C(圖2e,f)。
在這項研究中,自熱率大于60 °C/min被用作劃分熱失控的標準。耐人尋味的是,循環的LSPS樣品中的熱失控行為更加嚴重,從而顯示出在鋰的熔點附近的巨大溫度峰值。如圖2e所示,自熱的開始發生在177.1℃,并導致193.6℃的放熱。
此外,自熱速率上升到19652.2℃/分鐘(圖2f),這導致最高溫度為505.4℃。可以注意到,由于在ARC測試過程中沒有電流通過,所獲得的熱特征歸因于界面的化學成分,而不依賴于電池電阻。因此,循環和未循環樣品之間的任何界面成分的變化應該表現為不同的熱反應。
根據在未循環/循環的LPS、LPSCl和LSPS情況下檢測到的ARC特征,LSPS在電化學循環過程中可能涉及一種新的分解產物。即使這種分解產物是熱穩定的,它也有可能作為一種催化劑,導致另一種成分的分解,從而在界面上產生放熱作用。
通過對(i)SE與金屬鋰接觸24小時的樣品(未循環電池)和(ii)在0.1mA cm–2?,容量為10mA cm–2?(~100小時)的電化學循環的樣品進行XPS實驗,可以了解界面組成。對于未循環的LPS樣品,從S 2p和P 2p光譜中,檢測到Li2S(160 eV)、Li3P(126.8 eV)和還原磷化合物(131 eV)的形成(圖3a)。
在電化學循環后,這些峰值已經衰減,在XPS光譜中沒有觀察到(圖3a),這也表明LPS不會發生連續的分解。與金屬鋰接觸后,LPSCl分解為Li2S(159.9 eV)、Li3P(126.7 eV)和還原磷成分,如圖3b的XPS光譜所見。與以前的研究一致,LPSCl和LiCl中的Cl–?之間的結合能差很小,因此很難確定LiCl的存在。
對于循環的LPSCl樣品(圖3b),雖然Li2S峰的強度有很大的下降,但沒有觀察到對應于Li3P和還原磷成分的峰,從而表示夾層的非漸進性質。XPS實驗中觀察到的LPS/Li和LPSCl/Li界面的分解產物與之前的理論預測是一致的。由于循環/非循環的LPS和LPSCl樣品顯示出幾乎相同的熱反應(表1),觀察到的放熱(圖2a,c)可能是由于共同產物之一的熱分解。
此外,導致放熱的共同產物的數量也應該非常接近。由于LPS和LPSCl的相位不會隨著循環而增長,所以由于這些共同產品之一而產生的放熱源可能是有限的。雖然這種常見的產物有可能是Li2S、Li3P或還原的磷成分,但隨著Li金屬的反復電鍍和剝離,它們會被埋在界面上。
這與循環后這些成分的峰值強度降低有關。除了這些分解產物,P-S-Li硫成分和對應于PS43–?的磷成分是循環前后的常見成分(圖3a,b);這些成分可能是導致觀察到的放熱的潛在可能。
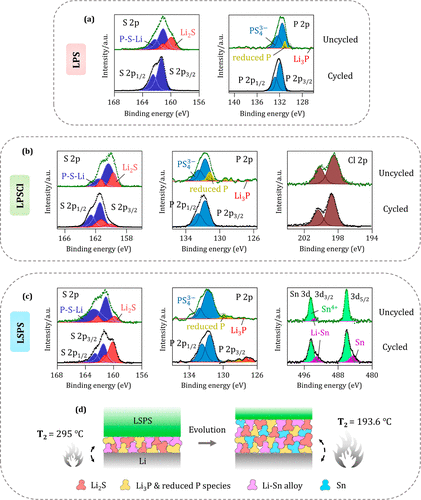
圖3.電化學循環前后的SE分解產物的比較。(a)LPS/Li界面的S 2p和P 2p核心區;(b)LPSCl/Li界面的S 2p、P 2p和Cl 2p核心區;以及(c)LSPS/Li界面的S 2p、P 2p和Sn 3d核心區。(d)LSPS/Li界面的界面演變,在循環過程中導致了Sn的形成。這種化學成分的變化顯示出與LSPS/Li界面的熱失控開始有明顯的關聯,它隨著循環從295℃下降到193.6℃。在(a-c)中,還原的P表示還原的磷成分,在(c)中,Li-Sn是指Li-Sn合金。
當LSPS與Li接觸時,從S 2p和P 2p光譜中確定了Li2S(159.8 eV)、Li3P(127.5 eV)和還原磷成分(129.9 eV)的形成(圖3c)。從Sn 3d光譜中,檢測到一個493 eV的峰值,根據理論預測,它應該對應于Li17Sn4?。因此,LSPS中的Sn4+?被還原成Li-Sn合金,這就是化學相的電子導電性能的原因。
與LPS和LPSCl相位相比,Li-Sn合金在未循環的LSPS相位中是一種獨特的成分。有趣的是, ARC結果與這種成分差異相關,也表示了熱反應的明顯變化。與LPS/LPSCl樣品(圖2b,d)相比,未循環的LSPS樣品(圖2f)顯示出超過20倍的自熱率,同時還出現了熱失控。
結合從ARC反應和界面成分中得到的啟示,界面中Li-Sn合金的存在可以影響未循環的LSPS/Li界面的熱不穩定性。雖然鋰-Sn合金本身可以是熱穩定的,但在達到一定溫度后,它可以促進另一個成分的形成或分解,這反過來可能導致界面上的放熱作用。未循環的LSPS樣品的這種放熱的表現,與LPS和LPSCl樣品不同,突出了界面作用和熱穩定性之間的基礎關聯。
與LPS和LPSCl相反,對于LSPS樣品,循環后仍然可以看到Li2S、Li3P和還原磷成分的峰(圖3c),這表示界面的連續生長。除了Li-Sn合金,在Sn 3d光譜中還觀察到一個新的峰值(圖3c),它與金屬Sn的結合能(484.6 eV)顯示出很好的一致性。
因此,與化學界面(未循環情況)相比,在電化學循環過程中,LSPS中的Sn4+?進一步減少為金屬Sn。界面成分的這種差異也顯示出與熱特征的有趣關聯(見圖2e)。未循環的LSPS樣品的熱失控發生在295.0℃,而循環的LSPS樣品的熱失控發生在193.6℃,伴隨著自熱率和最高溫度的急劇增加。根據ARC和XPS的綜合觀察,推斷出LSPS界面的演變與180℃附近的放熱反應有關。由于Li-Sn/Sn成分的電子傳導性,它們的存在導致了界面的持續增長,這影響了界面上的放熱程度。
此外,盡管循環的LSPS界面中的金屬錫可以是熱穩定的,但它可以作為催化劑,促進另一個成分的分解,反過來影響放熱反應的開始。總的來說,LSPS界面在循環前后的基本差異與ARC實驗中觀察到的明顯不同的熱反應相吻合。圖3d顯示了所提出的LSPS/Li界面的熱穩定性-界面關系的示意圖。
從ARC實驗中獲得的材料層面的熱特征(圖2)為SE/Li界面的放熱反應動力學提供了重要的洞察力。ARC曲線中從溫和放熱(從T1?)到熱失控(直到T3?)的過渡階段可以用來提取動力學參數[即活化能(Ea?)、頻率因子(A)]和反應焓(H),這些參數與每個SE/Li界面的放熱反應相對應,基于方程式S1和S2。
根據ARC實驗捕捉到的熱反應(圖2),未循環的LSPS/Li界面的放熱嚴重性通過與這種熱相互作用相關的增強的頻率因子(A)來說明。從物理上講,未循環的LSPS樣品從T1?到T3?的ARC特征表示界面上有很大的放熱反應速率。至于循環的LSPS/Li界面,大的放熱反應速率也伴隨著高的反應焓。
這些熱動力學參數的共同影響與ARC實驗中觀察到的循環LSPS樣品明顯較高的溫升和自熱率有關(圖2e,f)。與ARC的特征相一致,LPS和LPSCl樣品涉及與電化學循環前后的放熱作用有關的類似動力學參數。根據SE/Li界面的熱反應,開發了一個計算模型來捕捉電池水平上的溫度上升和自熱特性。
以LiCoO2?(LCO)作為代表陰極。對于LCO陰極,氧氣釋放和與Li反應的差示掃描量熱法(DSC)熱流數據被用來劃定相關的動力學參數。如公式1-3所示,SE/Li界面的熱動力學和LCO/Li的相互作用被用來預測電池水平的熱行為。
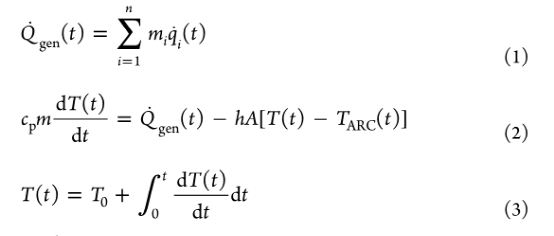
這里,Qgen?是總發熱率,mi?是反應物質量,qi?是反應的比熱,m是電池質量,h是總體傳熱系數,A是電池表面積,T是電池溫度,TARC?是ARC室的溫度,T0?是初始電池溫度。根據SE,電池級的熱穩定性在力學上受到固-固界面上熱相互作用的不同性質的影響。
首先用LSPS作為SE進行分析。對于未循環的LSPS電池,如圖4b所示,在255.0℃時只觀察到一個放熱階段。從物理學上講,這標志著以下機制。由于氧氣從LCO陰極釋放并與Li反應而導致的自熱的開始,先于由于LSPS/Li界面的自熱的開始。
然而,由于氧的釋放及其與Li的反應而產生的自熱速率導致溫度立即上升(1683.6℃/分鐘,見圖4c),這足以引發SE/Li界面的大規模放熱反應(發生在326.9℃)。由于這兩個反應之間的時間間隔在幾秒鐘之內,由于這兩個相互作用而產生的熱反應被觀察為一個單一的峰值,這導致最高溫度為748.0 °C。
然而,對于循環的LSPS電池來說,由于LSPS/Li界面產生的熱量首先出現在170.0℃(圖4c)。產生的熱量觸發了LCO陰極的熱分解,并導致隨后在261.0℃開始出現放熱,如圖4b所示。相反,對于未循環的LSPS電池,186.5℃的溫和放熱(見圖2e)不足以觸發LCO的熱分解。
總的來說,雖然由于SE/Li間的熱相互作用影響了陰極的反應,但在陰極釋放的氧氣也影響了隨后在陽極產生的熱量(圖4a)。把這種機理上的互動稱為 "電極串擾",它制約著熱失控的發生和嚴重程度。圖4d總結了由于SE/Li界面和LCO的氧氣釋放而產生的熱量,從而揭示了后者機制的重大貢獻。
在圖4d中,LIB和LMB指的是鋰離子電池和液基鋰金屬電池。直方圖中的橙色、綠色、紅色、紫色、藍色和黃色部分指的是SEI分解、陽極-電解質相互作用、陰極-電解質相互作用和電解質分解(對于LIB/LMB情況)以及SE/Li界面和Li/LCO相互作用(對于SSB情況)。由于金屬鋰電極與SE分解產物和氧氣的高度放熱反應,推斷SSB中產生的總熱量是LIB中產生熱量的3倍以上(圖4d)。
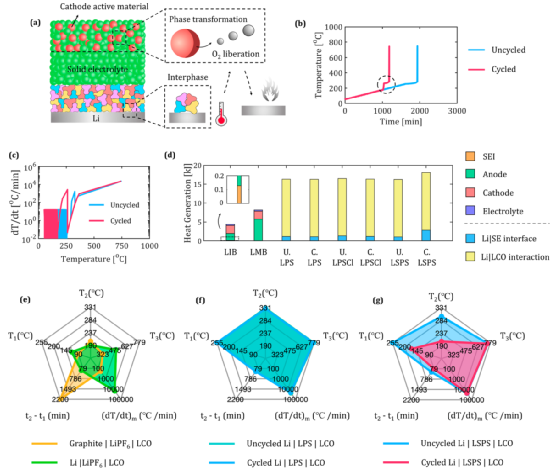
圖4.電池的熱穩定性。(a) 熱失控機制,包括界面/鋰的相互作用、O2?的釋放及其與鋰的反應,對于鋰|LSPS|LCO電池。(b,c) 1安培鋰|LSPS|LCO電池的溫升和自熱率。(d)LIB(石墨|LiFP6?|LCO)、LMB(Li|LiFP6?|LCO)和SSB(Li|SE|LCO)電池的發熱量比較。這里,U.和C.分別指未循環和循環的。(e)LIB和LMB,(f)未循環和循環的基于LPS的SSB電池,和(g)未循環和循環的基于LSPS的SSB電池的熱安全特性。
圖4(e-g)中的蜘蛛圖總結了LIB(帶石墨陽極)、LMB和以LCO為陰極的1Ah容量的SSB的五個關鍵熱安全屬性。這里,(t2?-?t1?)表示T1?和T2?之間的時間間隔,(dT/dt)m?表示最大溫升率。
LIB和SSB之間存在三個主要區別:(1)LIB的自熱(T1?, 90 °C)和熱失控(T2?, 205 °C)的起始溫度(圖4e)比任何SSB的情況(圖4f,g)都低。(2) 然而,SSB的(t2?-?t1?)明顯低于LIB。這在物理上是指SSB在T1?之后有更高的自熱率。(3)最后,與LIB相比,SSB的(dT/dt)m?和最高達到的溫度(T3?)要大得多。
例如,LIB和SSB的T3?,分別為323℃和744-779℃。總的來說,這意味著雖然SSB需要更大的溫度來啟動熱失控,但一旦達到這個極限,自熱率和溫度上升是非常嚴重的。此外,從圖4g可以看出,在像LSPS這樣的SE中,由于界面生長造成的降解在決定熱失控的發生方面起著關鍵作用。
由于SSB的溫度上升幅度很大,因此了解能量釋放的極限和可能導致熱失控的加熱情況非常重要。在這種情況下,一個關鍵的考慮因素是發生內部短路,導致儲存的電能轉換為熱能。例如,在各種SE中,包括像LPS、LPSCl和LSPS這樣的硫化物,已經觀察到了因燈絲生長而發生的短路。
電池的安全性,在應對短路時,取決于(i)比能量(Eg?),(ii)在正常電池操作期間發生的溫度上升(Tcell?operation),以及(iii)導致熱失控的自我加熱的起始溫度(T1?)。在數學上,這些影響可以被歸納為安全系數(fsafety),其定義為
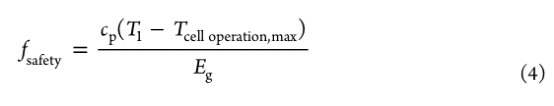
其中fsafety代表Eg的最小部分,需要轉化為熱量才能達到T1?,并導致熱失控,cp?表示電池比熱。通過建立一個耦合的熱電化學模型來評估Tcell?operation,該模型可以捕捉到歐姆熱(Qohmic?=?kSE?? ΦSE?? ΦSE?)和動能熱(Q?kinetic?=?jreactionη)對電池運行期間內部溫度上升的影響。
這里,kSE?是SE 的離子傳導率,ΦSE?是離子傳輸的電動勢,jreaction?是反應電流密度,η 是過電位。T1?是從ARC結果中得到的。在公式4的基礎上,評估了基于LSPS的SSB電池的fsafety(圖4g)。如圖5a所示,內部溫升(ΔT)隨著充電電流和比能量(Tcell?operation,max?=?Tambient?+ ΔT)的增加而升高。
此外,比能量對公式4中的fsafety構成直接限制。因此,在未循環的情況下,隨著比能量從200Wh/kg增加到300Wh/kg,fsafety從0.3下降到0.2~(圖5b)。此外,圖5b還意味著隨著電流密度的增加,安全系數也會降低。最重要的是,觀察到循環電池的安全系數急劇下降,這歸因于T1?的較低值(圖5c)。因此,SE/Li界面的界面演變對SSB的電池級熱安全有深刻的影響。
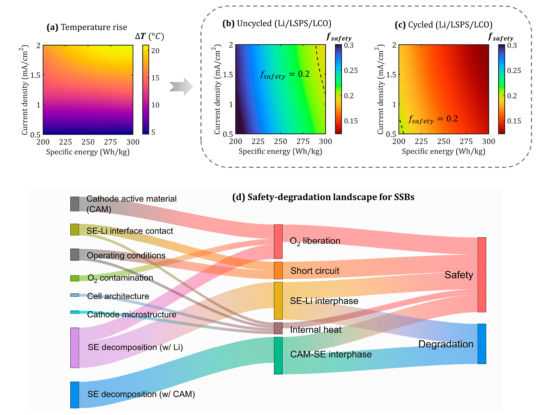
圖5.SSB的安全狀況。(a)電化學操作過程中的內部溫度上升是比能量和充電電流密度的函數。(b)未循環和(c)循環的基于LSPS的SSB電池的安全系數(fsafety)評估。(d)Sankey圖說明了影響SSBs中耦合安全降解反應的機械相互作用。
這項工作對界面特性和電極串擾對固態電池熱安全的影響提出了基本的見解。對三種典型的硫化物,即LPS、LPSCl和LSPS,研究了SE/Li界面的熱特征和界面演變之間的基本聯系。重要的是,本工作發現,雖然LSPS/Li界面即使在未循環狀態下也會表現出熱失控,但電化學循環大大加劇了這種行為,這導致在Li的熔點附近出現巨大的熱峰值。根據這些材料層面的特征,開發了一個計算模型來探測電池層面的熱反應,并劃定安全圖作為SE/Li界面、電極串擾和比能量的函數。
在這項研究的推論基礎上,提出了對SSBs安全和降解反應的復雜耦合的機理觀點(圖5d)。雖然內在的SE/Li界面對界面生長機制起著關鍵作用,但評估外在因素,如壓力和溫度對界面特性和熱穩定性的潛在影響,可能是未來研究的一個重要途徑。
與SE/Li界面類似,了解陰極中SE的分解和相關的界面行為如何影響熱安全也是至關重要的。除了在SE的不可燃性方面的典型安全描述外,本工作研究表明在固-固界面的電-化學-機械性質和它們的熱穩定性之間建立一個全面的關聯的必要性。
審核編輯:劉清
 電子發燒友App
電子發燒友App























評論