編者按
癲癇(復發性無因癲癇)十分常見,但目前對于其發病機制尚不清楚。抗驚厥藥物是目前的一線治療方法,但是三分之一的患者患有藥物難治性癲癇(DRE)。目前只有切除性癲癇手術,即切除部分引起癲癇的腦組織,才能提供治愈方法。因此,深入研究癲癇的發病機制是十分重要的。研究者做出假設,不適當的促炎機制可能是人類患者的難治性癲癇(對抗癲癇藥物無反應性)的發病機制。通過CITE-seq,揭示手術切除的癲癇病變組織的免疫轉錄組。本研究揭示了一種促炎微環境,包括小膠質細胞的廣泛激活和其他促炎免疫細胞的浸潤。通過配體-受體(LR)相互作用分析提供了小膠質細胞和T細胞之間的潛在浸潤機制和直接的物理相互作用的證據,從而驗證了上述發現。總之,這些數據提供了對癲癇組織中的免疫微環境的理解,并且可能為DRE和一些其他神經炎癥疾病的介入治療提供指導。
1. 定義癲癇患者大腦中的駐留性和浸潤性的免疫細胞
為了確定影響癲癇發生的免疫機制,研究者對手術切除的癲癇病灶組織進行了單細胞轉錄組和表面蛋白測序(CITE-seq)。首先從6個體患者的11個腦組織樣本中分離免疫細胞,并使用10x Genomics單細胞平臺進行測序,分析了85780個細胞和22968個基因數據。對基因表達水平進行聚類和t-SNE分析,共鑒定26個聚類。接下來進一步利用表面蛋白標記物鑒定集群,結果顯示:簇0-7、9-12和14(共13個簇)被鑒定為小膠質細胞(CD45lo),簇8、15-17、19和21(共6個簇)被鑒定為浸潤性免疫細胞(CD45hi)。通過單細胞測序分群,能夠同時識別大腦中的小膠質細胞、免疫細胞和非免疫細胞,并能夠定量譜系特異性表面蛋白和基因表達水平。
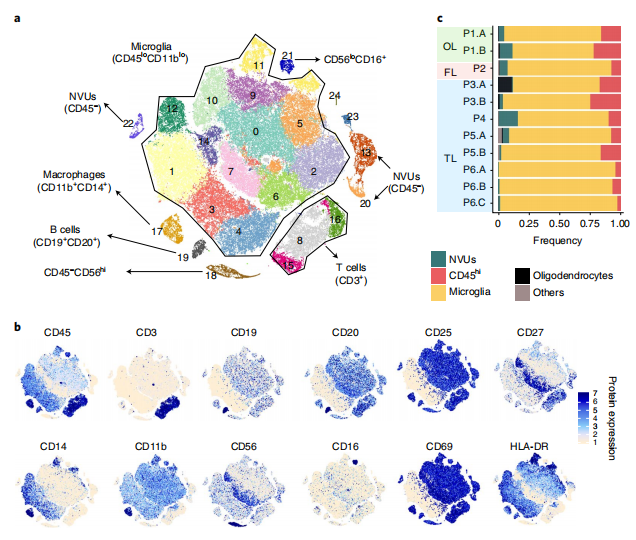
Fig.1 DRE患者腦組織中的小膠質細胞和浸潤性免疫細胞
2. 小膠質細胞在DRE組織中表現出促炎表型
接下來,為了研究在DRE組織中的小膠質細胞中是否可以發現炎癥通路的激活,研究者分別通過單核細胞測序(snRNA-seq)和scRNA-seq,對來自非神經系統疾病對照組和ASD患者的腦組織、以及來自于在癲癇手術中被病理評估為正常的切除的人類腦皮層組織mRNA的表達進行分析。結果顯示,在snRNA-seq和scRNA-seq數據中,來自非神經系統疾病對照組和ASD患者的小膠質細胞都表達了特征性的小膠質細胞標記物。來自DRE患者的小膠質細胞顯示了促炎細胞因子和趨化因子基因的表達。然而,在snRNA-seq數據集中,來自非神經系統疾病對照組或ASD的小膠質細胞并沒有顯示出這些促炎細胞因子和趨化因子的表達。通過比較DRE患者、非神經系統疾病對照組和ASD個體的小膠質細胞基因表達,可以發現DRE小膠質細胞的炎癥反應明顯升高。研究者通過免疫組化(IHC)成像分析對大腦微環境進行成像,進一步驗證了上述發現。
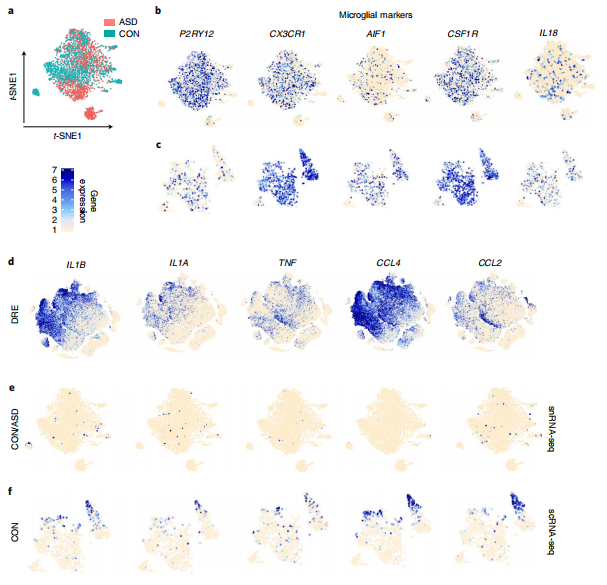
Fig.2 DRE患者、非神經系統疾病對照組和ASD患者腦組織中促炎基因和小膠質細胞特異性基因的表達
3. NVUs與免疫細胞之間的功能性配體-受體相互作用
為了研究來自DRE-M的NVUs與浸潤性白細胞之間的相互作用,研究者創建了一個NVUs內的細胞與浸潤性免疫細胞之間的配體-受體(LR)相互作用的細胞網絡,結果發現節點之間共有809個LR相互作用,其中有265對獨特的LR對(有206對出現在NVU和CAM集群之間)。接下來,研究者進一步探討了這種關系機制,結果發現所有三個CD4+節點均富集了IL7R的表達,編碼其同源受體的TSLP在NVUs中富集;TNF、CCL5和TGFB1在免疫細胞簇中表達,而它們的同源受體TNFRSF21、ACKR1和ACRL1在NVUs中表達,并使用CellChat R包進一步驗證了它們之間的互作結果。總之,LR相互作用組網絡定義了免疫細胞浸潤偏向DRE-M的機制。
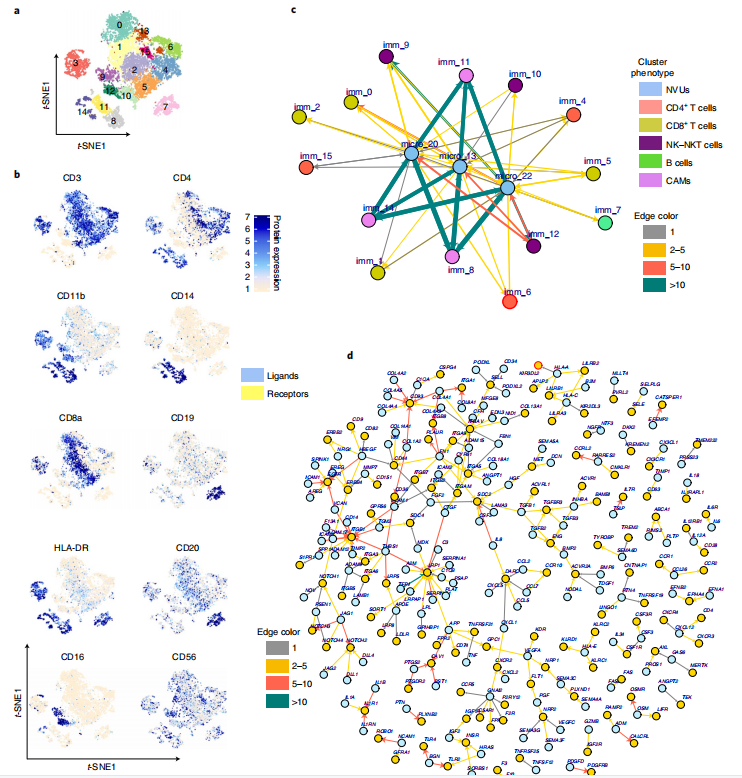
Fig.3 癲癇人腦免疫細胞及其與NVU細胞的相互作用
為了進一步驗證上述發現,研究者建立了TLE小鼠模型進行單細胞測序。RNA-seq數據分析發現,與對照組小鼠相比,TLE小鼠中有1600個基因顯著改變,有122個LR基因在人類DRE中富集。在這些LR基因中,許多關鍵的LR對,包括趨化因子和細胞因子及其受體基因在TLE小鼠大腦中上調。總之,動物癲癇模型進一步的證實了人類單細胞測序的數據。

Fig.4 LR基因在TLE癲癇小鼠模型中顯著調節
4. 小膠質細胞和T細胞之間的直接相互作用
Cluster 3表達CD3、CD11b和HLA-DR表面蛋白,說明該群是T細胞和小膠質細胞和/或巨噬細胞的雙態簇。接下來研究者使用主要譜系蛋白表達標記對Cluster 3進行重新聚類,進一步分析了這些雙態簇的成分。結果共獲得6個cluster,包括CD8+ T細胞群(Cluster 0)、CD4+ T細胞群(Cluster 1)、B細胞群(Cluster 4)、NK細胞(Cluster 2)和巨噬細胞簇(Cluster 5)。研究者使用物理相互作用細胞測序(PICs)(PIC-seq),尋找由于物理相互作用而被調節的基因,隨后將差異表達的基因與來自兩種細胞類型的小膠質細胞和T細胞的預期貢獻進行比較。結果顯示,在物理相互作用后,促炎和細胞毒性功能相互增強。最后,研究者使用IHC和流式細胞術驗證了T細胞-小膠質細胞雙重免疫復合物,結合PIC-seq和IHC分析,發現與未直接接觸的小膠質細胞和T細胞相比,小膠質細胞免疫細胞雙細胞明顯顯示出增加的促炎功能。
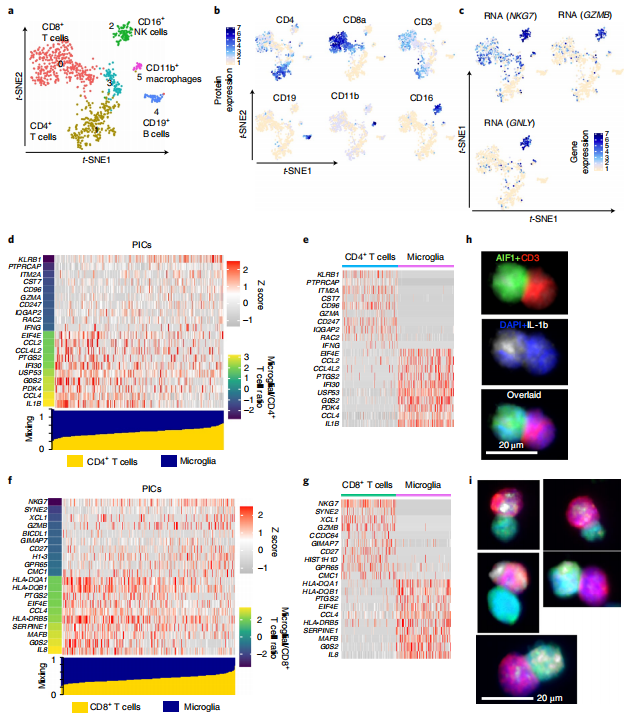
Fig.5 難治性癲癇患者腦組織中小膠質細胞與浸潤性T細胞的直接相互作用
主要結論
本研究通過單細胞轉錄組和表面蛋白測序(CITE-seq),揭示手術切除的癲癇病變組織的的促炎微環境,包括小膠質細胞的廣泛激活和其他促炎免疫細胞的浸潤,同時還提供了小膠質細胞和T細胞之間的潛在浸潤機制和直接的物理相互作用的證據,從而驗證了上述發現。總之,這些數據提供了對癲癇組織中的免疫微環境的理解,并且可能為DRE和一些其他神經炎癥疾病的介入治療提供指導。
-
數據
+關注
關注
8文章
7134瀏覽量
89403 -
神經系統
+關注
關注
0文章
84瀏覽量
13005 -
細胞
+關注
關注
0文章
66瀏覽量
18361
原文標題:單細胞轉錄組學和表面表位檢測--確定人腦癲癇病灶中促炎癥的信號傳遞
文章出處:【微信號:SBCNECB,微信公眾號:上海生物芯片】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 癲癇組織中的免疫微環境為DRE和神經炎癥疾病的介入治療提供指導
癲癇組織中的免疫微環境為DRE和神經炎癥疾病的介入治療提供指導











評論