循環伏安法(CV)
CV的基本原理,是使用不同的電位掃描速度對被測體系作伏安曲線,如式(9)所示:

式(9)中:IP為峰值電流;R為理想氣體常數;T為溫度;v為掃描速度。
CV是目前最常用的電化學技術之一,測定DLi+的操作簡單,對于數據處理,只需繪出IP和v1/2的關系曲線,根據式(9)即可求得DLi+。T.T.D.Tran等[1]在研究LiFePO4/C納米復合電極材料的電化學性能時,基于CV求得DLi+為2.2×10-12cm2/s,與其他文獻報道的由CV、GITT和EIS測得的數據一致。
CV法雖能較簡易地得到DLi+,但得到的是充放電過程中的平均擴散系數。由于CV過程中濃度變化較大,基于該技術確定擴散系數的可靠性較差。此外,CV只能快速而粗略地估計擴散系數的數量級,因此,很多研究者為了實驗的完整性,多采用CV輔助觀測氧化還原峰,以研究電化學反應的機理,DLi+則用其他方法,如 EIS計算得出。
C.J.Lyu等[2] 在研究Nb摻雜對一維納米結構NCM正極材料的影響時,通過CV觀察到Nb-NCM的氧化峰和還原峰電位差均小于NCM,證明摻雜Nb可提高庫侖效率,緩解電化學極化。通過EIS計算,得出Nb-NCM的DLi+為1.8×10-10cm2/s,大于NCM的1.13×10-12cm2/s,表明Nb摻雜有利于Li+的遷移。
容量間歇滴定法(CITT)
CITT是通過引入電位-電荷容量與電流-電荷容量之比(RPG),在此基礎上發展起來的、連續測定DLi+的方法。具體推導如下。
根據球形擴散模型,恒壓-恒流充電值q可表示為:
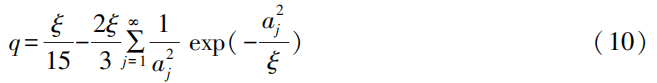
式(10)中:ξ為定義的無因次變量,取值為r2/DLi+tG;tG為恒流充電時間;aj為常數列。
對式(10)進行線性擬合,可得:
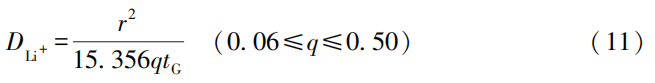
CITT的優勢在于數據處理相對簡單。其他測試方法需要許多互補的參數,包括活性材料組成、嵌鋰量、有效表面積和摩爾體積等,而CITT只要測試出r、q和tG,即可得到DLi+。q和tG可由CITT循環曲線求得,因此只用測定r,即可求得DLi+;CITT還可連續確定不同充電狀態和不同循環情況下的DLi+ 。
S.Y.Wang等[3]利用KMnO4控制氧化MnCO3前驅體與鋰鹽的固相反應,制備LiMn2O4固相微球和壁厚可調節的空心微球,在研究結構對LiMn2O4作為鋰離子電池正極材料性能的影響時,通過CITT測得樣品LMO-3、LMO-5和LMO-S(LMO-y,y指KMnO4與MnCO3反應的時間,min;S指固相微球)的DLi+在10-11~10-8.5cm2/s數量級,且LMO-3數值最大,證明壁厚較薄的LMO-3的Li+遷移率更高。
王盈來等[4]合成NCM粉末正極材料,利用CITT測得,DLi+隨電位和循環次數的不同分布于10-12~10-11.5cm2/s;電位在3.9~4.3V時,DLi+較為穩定;循環次數越多,DLi+越穩定。事實上,,相比于其他電化學方法,盡管CITT處理數據更簡單,但更多的學者仍傾向于使用EIS、GITT等這些經過實踐且更為成熟的方法,因此,CITT實際運用并不廣泛。
審核編輯 :李倩
-
電化學
+關注
關注
1文章
325瀏覽量
20664 -
測定
+關注
關注
0文章
122瀏覽量
11782 -
電極材料
+關注
關注
0文章
84瀏覽量
6618
原文標題:Li+擴散系數的測定: 循環伏安法(CV)和容量間歇滴定法(CITT)
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
循環伏安法(CV)基礎知識
基于微流控芯片的在線滴定
GBT7600-2014運行中變壓器油和汽輪機油水分含量測定法(庫侖法)
GBT7601-2008運行中變壓器油、汽輪機油水分測定法(氣相色譜法)
掃描速率對循環伏安圖的影響
掃描速率與峰值電流和峰值電勢的關系
掃描速率和濃度對循環伏安圖有什么影響
間歇振蕩器的特點和應用場景
摻雜對PN結伏安特性的影響
三星貼片電容的容量換算





 循環伏安法(CV)和容量間歇滴定法(CITT)
循環伏安法(CV)和容量間歇滴定法(CITT)










評論