鋰電池是一類以金屬鋰或含鋰物質作負極的電的化學源總稱,自1991年鋰離子電池問世并商業化生產以來,鋰離子電池因具有高的比能量,長循環壽命,低自放電和綠色環保等一系列優點,受到當今社會的廣泛關注和大力發展。
一、基本原理
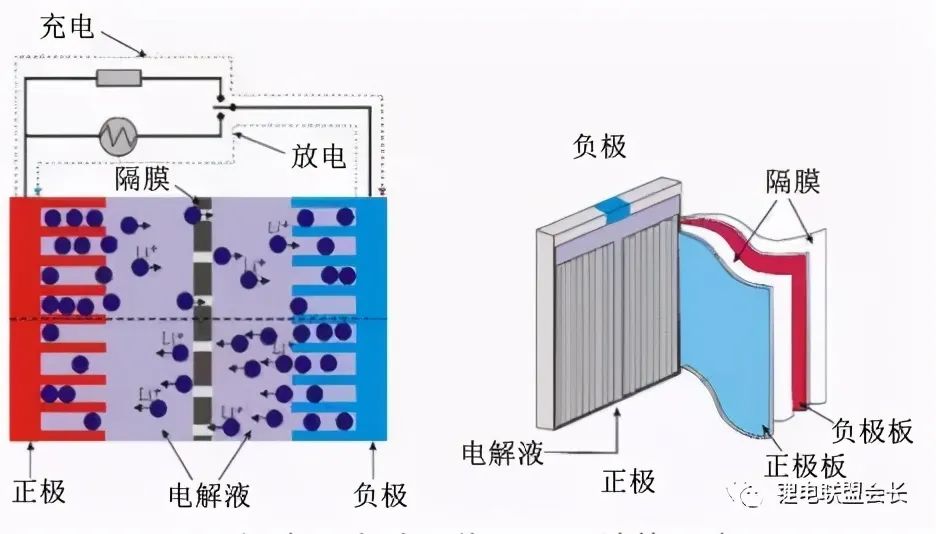
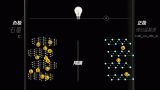
所謂鋰離子電池是指分別用兩個能可逆地嵌入與脫嵌鋰離子的活性物質作為正負極構成的二次電池。電池充電時, 鋰離子從正極脫嵌, 經過電解質嵌入負極,放電時,鋰離子則從負極脫出, 插入正極。
以將炭材料為負極,以含鋰的化合物作正極的鋰電池為例。在充放電過程中,沒有金屬鋰存在,只有鋰離子。當對電池進行充電時,電池的正極上有鋰離子生成,生成的鋰離子經過電解液運動到負極。而作為負極的碳呈層狀結構,它有很多微孔,達到負極的鋰離子就嵌入到碳層的微孔中,嵌入的鋰離子越多,充電容量越高。同樣,當對電池進行放電時(即我們使用電池的過程),嵌在負極碳層中的鋰離子脫出,又運動回正極。回正極的鋰離子越多,放電容量越高。我們通常所說的電池容量指的就是放電容量。在Li-ion的充放電過程中,鋰離子處于從正極→負極→正極的運動狀態。Li-ion Batteries就像一把搖椅,搖椅的兩端為電池的兩極,而鋰離子就象運動員一樣在搖椅來回奔跑。所以Li-ion Batteries又叫搖椅式電池。
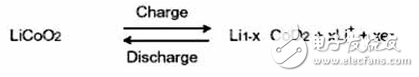
正極反應:放電時鋰離子嵌入,充電時鋰離子脫嵌。
正極可選材料很多,目前主流產品多采用鋰鐵磷酸鹽
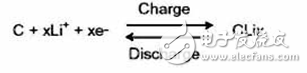
負極反應:放電時鋰離子脫插,充電時鋰離子插入。
負極材料多采用石墨。
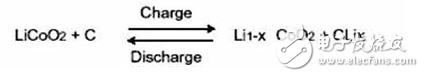
電池總反應:
鋰離子電池是由電極材料、電解質和隔膜等部分組成, 其性能在很大程度上取決于電池組成材料的性能和制備工藝,尤其是正極和負極材料。因此研究高能鋰離子電池的關鍵技術是采用在充放電過程中能可逆地嵌脫鋰離子的正、負極材料。
二、正負極材料
(一)正極材料
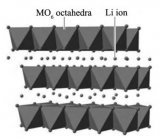
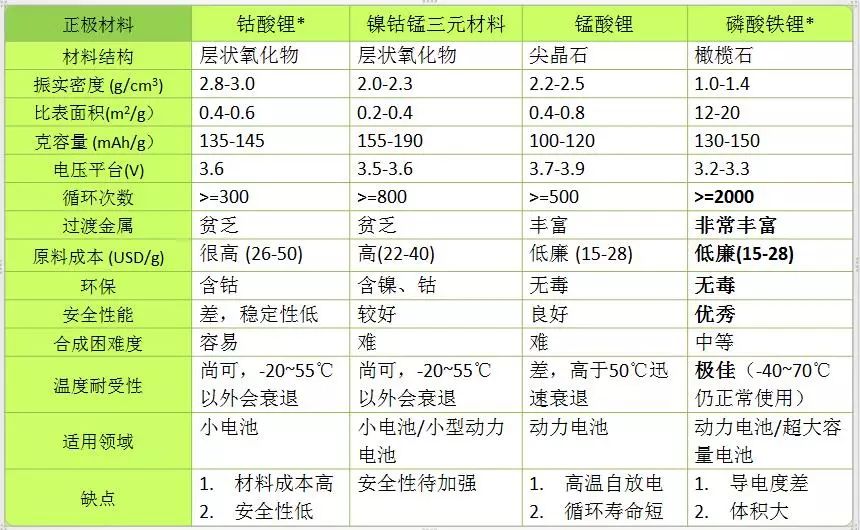
正極材料是鋰離子電池發展的關鍵技術之一,應滿足條件:①足在所要求的充放電范圍內, 與電解質溶液有電化學相溶性;②溫和電極過程動力學;③高度可逆性:④全鋰化狀態下在空氣中穩定性好。目前,常用的正極材料層狀 LiMO2和尖晶石型LiM2O4(M=Co, Ni, Mn, V等過渡金屬離子)。
2.1.1 LiMO2型化合物
LiCoO2屬α-NaFeO2型結構, 具有二維層狀結構, 適宜鋰離子脫嵌。由于其制備工藝簡便,性能穩定, 比容量高, 循環性好, 目前商品化鋰離子電池大都采用LiCoO2作為正極材料。但是由LiCoO2價格較高, 且過充電時易導致不逆容量損失和極化電壓增大 , 因此人們不斷尋找和研究高比能, 低成本, 穩定性好的新型正極材料。
LiNiO2比LiCoO2廉價,其結構與LiCoO2相近,它具有較好的高溫穩定性,低自放電率,與多種電解液有良好的相溶性,是繼LiCoO2后研究較多的層狀化合物。但LiNiO2制備困難, 要在氧氣氣氛下合成, 工藝條件控制要求高,這些都影響了它在鋰離子電池中的應用, 如果通過摻入或Mn或Co等其它元素, 可得到較好的可逆性及較高的放電電位段。故LiNiO2的制備研究仍吸引著眾多的研究者。
釩的價格較鈷低, 亦能形成層狀化合物,但與LiCoO2 有所不同, 即當Li+脫嵌時, 層狀的LiVO2變得不穩定, 在Li1- xVO2中, 當x《0.3時, 約有1/3的釩離子從釩層遷入缺鋰層形成電化學活性很小的有缺陷的巖鹽結構, 從而破壞了鋰離子擴散用的二維平面, 且鋰離子不能再生成原有的層狀結構。
由于錳來源廣泛, 價格不到鈷的10% , 且低毒, 易回收, 各種嵌鋰的氧化錳材料備受重視。層狀的LiMnO2一般用層狀的巖鹽結構化合物Li2MnO3 (Li2OMnO2) 酸處理制備 ,與LiCoO2不同, 這種LiMnO2屬正交晶系, 在2.5~4.3V之間充電, 可逆容量為200mAh·g-1左右,經過第一次充電,正交晶系的LiMnO2轉變為尖晶石型的LixMn2O4。因這種LiMnO2在空氣中穩定, 而尖晶石型的LixMn2O4在空氣中不穩定。
2.1.2尖晶石型LiM2O4
尖晶石型的LiM2O4 (M = Mn,Co,V等) 中LiM2O4骨架是一個有利于Li+擴散的四面體與八面體共面的三維網絡, 氧原子作立方緊密堆積, 75% 的M原子交替地位于立方緊密堆積的氧層之間, 余下的25%M原子位于相鄰層, 因此,在脫鋰狀態下, 有足夠的M陽離子存在于每一層中, 以保持氧原子理想的立方緊密堆積狀態。
LiMn2O4是尖晶石型嵌鋰化合物的典型代表, 有眾多的研究者對其進行過廣泛而深入的研究。LiMn2O4具有三維隧道結構, 更適宜鋰離子的脫嵌, 同時也是正極材料中成本最低的, 其耐過充性及安全性也更好, 對電池的安全保護裝置要求相對較低。但是, 因為在加熱過程中易失去氧而產生電化學性能差的缺氧化合物,使高容量的LiMn2O4的制備較復雜,現在常用的合成方法有多步加熱固態合成法,溶液-凝膠法,沉淀法,Pchini法等。
對于LiCo2O4,其在400℃左右制備的結構類似于尖晶石型的LiMn2O4,其放電電壓約比層狀LiCoO2低0.15V,循環性能差,這主要是因LiCo2O4并非理想的尖晶石結構, 但經過適當的酸處理后, 可以改善LiCo2O4的循環性能。
與LiVO2類似, 尖晶石型的LiV2O4作為正極, 在鋰的脫嵌過程中, 結構從尖晶石變成有缺陷的巖鹽型, 約有1/9的釩離子從富釩層進入相鄰層而破壞了供鋰離子擴散用的三維空間而限制了該化合物的應用。然而, 由于價格上的優勢, 嵌鋰的氧化釩仍受到人們關注, 采用新的制備方法,如模板合成法、水熱法以及摻入其它金屬離子或導電高分子材料,以設法穩定脫鋰狀態下的晶體結構及其充放電的可逆性, 將是推動嵌鋰氧化釩在鋰離子電池中應用的最有希望的途徑。
就目前而言,鋰電池正極材料仍以鈷酸鋰為主。 除了其結構穩定性佳、能量密度高的特性外。最早應用于可攜式電子裝置等小型電池領域也是一大原因。此外, 隨著鋰電池爆炸事件陸續發生后,正極材料研究重點轉向安全性開發。其中錳酸鋰電容量雖然較低,但其安全性較高,也讓其在大型鋰電池或動力電池市場滲透率逐年提升,至于磷酸鋰鐵相較于鋰錳系具有更高的熱穩定性,在成本考量上也比鋰鈷氧化物更具優勢,使得磷酸鋰鐵和鋰錳系在未來鋰電池市場的應用備受期待。
(二)負極材料
鋰離子電池負極材料作為提高鋰離子二次電池能量及循環壽命的重要因素, 在世界范圍內得到了廣泛的研究。作為鋰離子電池負極材料應滿足以下要求:①在鋰離子的嵌入反應中自由能變化小、電位低;②鋰離子在負極的固態結構中有高的擴散率;③高度可逆的嵌入脫出反應;④有良好的電導率;⑤熱力學上穩定, 同時與電解質不發生反應。常見的負極材料按成分劃分可分為碳材料和金屬氧化物材料。
2.2.1碳材料
石墨,是目前鋰離子電池最常用的負極材料。嵌鋰石墨屬離子型層間化合物, 理論容量為372mAh·g-1, 鋰的嵌入與脫嵌反應發生在0~0. 25V之間, 具很好的電壓平臺。當前, 用嵌鋰石墨作負極時, 研究的焦點問題有: 不可逆容量損失的機理和抑制辦法, 以及石墨結構與電化學性能的關系。
所謂不可逆容量損失是指碳電極的鋰離子不能從碳電極中脫嵌, 這主要發生在第一次充放電循環,除了溶劑分解的因素外, 石墨電極本體內部的活性位點與鋰離子反應也是產生不可逆容量損失的原因。電解液中加入添加劑,如加入12-冠-4-醚, 可以抑制溶劑分解;而適度地氧化石墨,使石墨某些特殊位點產生納米微孔, 可獲得良好的循環性能。此外在石墨負極中混入銀粉也可以改善循環性能。
通過采用上述方法的改進, 目前報道的石墨類碳材料的插鋰容量已達到300mAh·g-1以上,并且其循環性能也較優異。
然而,石墨由于只形成LiC6,其理論容量只有372 mAh·g-1,,為提高鋰離子電池的能量和功率密度,納米碳負極材料,比如碳納米管(CNTs)、石墨稀、介孔碳等已經被開發用作存儲Li。
碳納米管(CNTs)是最典型的碳納米結構,其電學性能優異,機械強度強,化學穩定好,比表面積高,活化比表面大。在CNTs發現后不久人們就研究其在鋰離子電池方面的應用。對Li蒸汽與CNTs的反應研究并測試其對應的電化學性能表明,CNTs可以在非石墨層與管內表面之間提供利于Li插入的夾層。小直徑的CNTs可以在六邊形的平面鍵產生應變,這種應變引起電子離域和使得結構比周期性的石墨片更具有負電性,反過來增加Li的嵌入程度。作為鋰離子電池負極材料的CNTs可逆容量可以達到460 mAh?g-1人通過各種后續處理如球磨酸氧化等可以達到1116mAh?g-1。相對于石墨材料,CNTs的容量有很大的提高,但是CNTs中引入大量的結構缺陷和高電壓滯后,其庫倫效率低于石墨。
石墨稀,以一個原子厚度為基本結構的二維單層碳。由于其具有優異的物理、化學、機械性能,比如超高的比表面、均一的多孔結構、寬的電化學窗口,吸引人們展開對其用作鋰離子電池負極材料的研究。鋰離子不僅能儲存石墨稀的兩側,還能在邊緣處、缺陷、位錯和石墨烯片的共價點處,這些使其具有較高的儲鋰容量。通過剝落石墨方法的得到石墨烯材料具有高的比表面,通過預處理可得到的官能團修飾的表面。單位結構的石墨烯的聚集和石墨的無規則的排列提供了了更多的空隙。用化學法合成石墨烯納米片用作鋰離子電池負極材料,其放電充電容量分別為945 mAh?g-1和650 mAh?g-1。但是石墨烯基的負極材料有較高的充電/放電容量、較低的庫倫效率和大的不可逆容量,這種不可逆容量歸于Li+與含氧官能團的反應和在氧化石墨處固體電解質的形成。另一個原因是由于石墨烯高的表面積/體積使得嵌入其中的電解液增加而導致高的不可逆容量。
石墨稀與活性金屬(Sn、Si)或金屬氧化物(Co3V4、Fe3O4、Mn3O4、CuO、SnO2)納米粒子的復合可以減少不可逆容量提高循環壽命。利用兩步液相反應法將Mn3O4納米顆粒負載到還原石墨烯片(RGO)上,測試其用于鋰離子電池負極材料的性能,發現其可逆容量高達900 mAh?g-1,即使在1600 mA?g-1的電流密度下其容量仍有390 mAh?g-1,表現了較高的可逆容量和較好的循環性能。因此,石墨烯和金屬或金屬氧化物納米顆粒之間的協同效應可增加鋰存儲容量,改善循環性能和倍率容量。
介孔材料相對于傳統的石墨碳材料具有明顯高的容量。Li+在0.1-0.5 V的電壓范圍內脫出,其首次容量為3100 mAh?g-1人對應著Li8.4C6化合物的生成。在100 mA?g-1的電流密度下,可逆容量為850-1100mAhg-1對應于LixC6(x = 2.3-3.0)的化學式。然而,介孔碳通常在充電放電曲線中表現出一個較高的不可逆容量和磁滯現象,這是這類材料的特性,太大的比表面導致太多的活化點從而使得電極/電解液界面發生不可控反應。在電化學上這些特性將阻礙其在鋰離子電池的應用。
2.2.2金屬氧化物材料
碳作為鋰離子電池的負極, 由于在有機電解質溶液中碳表面形成能讓電子和鋰離子自由通過的鈍化層, 這種鈍化層保證了碳電極良好的循環性能。然而, 也會引起嚴重的第一次充放電不可逆容量的損失。有時甚至能引起碳電極內部的結構變化和電接觸不良, 另外, 高溫下也可能因保護層的分解而導致電池失效或產生安全問題, 因此, 幾乎與研究碳負極的同時, 尋找電位與Li+/Li 電對相近的其它負極材料的工作一直受到重視。
各種金屬氧化物早已被廣泛研究作為潛在的負極材料,這些材料具有不同的物理和化學性質,并能提供在500-10000mAh·g-1之間的高可逆容量。根據反應機制,可以將金屬氧化物基負極分為三組:(1)鋰-合金反應機理(SnO2); (2)嵌入/脫出反應機理,其中包括鋰在過渡金屬氧化物晶格中的插入和拔出(TiO2);(3)轉換反應機理包括氧化鋰的生成和分解,同時伴隨著金屬納米粒的還原和氧化(MOx,M= Fe、Co、Ni、Mn、Cu、Mo、Cr等)。三中反應機制顯示如下:
鋰-合金反應機理:
MxOy+2yLi++2ye-→xM+yLi2O
M+2Li++2e-→LizM
插入反應機理:
MOx+yLi++ye-→LiyMOx
轉換反應機理:
MxOy+2yLi++2ye-→xM+yLi2O
鋰-合金反應以SnO2為例,二氧化錫(SnO2)在金屬氧化物材料中是非常有希望的,第一次的放電中Li與SnO2反應生成Li2O和Sn,隨后繼續與Li反應生成合金Li4.4Sn,對應的理論容量為783 mAh·g-1。然而,在連續幾次循環之后,從Li-Sn合金中脫出來的Sn表現了相互之間聚集的趨勢并形成團簇。這種不可逆容量惡化的原因與Sn的體積變化和支撐插入到Li中還原態Sn顆粒的Li2O基體遭到破壞有關。研究重點放在提高SnO2循環性能和減少不可逆容量上。近幾年二氧化錫/碳納米復合材料,如SnO2碳納米膠質、SnO2碳納米粒子,這些材料具有較高可逆的儲鋰能力和改良的循環性能。這源于導電碳基質的良好穩定性與SnO2納米粒子高的鋰儲存能力的協同效應。在SnO2碳納米復合材料中,碳作為防止SnO2粒子團聚的屏障,能在SnO2粒子經歷體積變化時提供一個緩沖空間而不出現結構丹塌。
幾種過渡金屬氧化物可以通過插入反應機理儲存鋰。對于可充電鋰離子電池而言由于其低成本和無毒性,這些材料是比較吸引注意力的。然而,插入反應中涉及的電子數量一般小于鋰,因為鋰只能插入在金屬氧化物晶體的空位中。因此,插入反應基體的金屬氧化物負極的比容量相對較低。二氧化鈦有多種晶型,如銳鈦礦、金紅石和TiO2-B。銳鈦礦通常被認為是最具導電活性的鋰插入體,因為對于銳鈦礦氧化鐵,不僅鋰插入的電壓低,而且鋰嵌入、脫出的動力學快。二氧化鈦納米管結構為鋰離子和電子的傳輸提供了有效的途徑,這是高效率可充電鋰離子電池所必需的。二氧化鎢是另一個伴隨鋰插入儲存機制的過渡金屬氧化物,其工作電壓較低;然而,這種材料通常存在嚴重的不可逆分解和較差的循環性能。
轉換反應機制引起研究者極大的興趣,因為許多重要的過渡金屬氧化物(MOx, M = Fe、Co、Ni、Mn、Cu、Mo、Cr等)在電極反應中遵循這一機制。根據轉換反應的公式MxOy+2yLi++2ye-→xM+yLi2O,這些氧化物在第一次鋰轉化過程中,被轉換成含有金屬狀態同時伴隨著Li2O生成,脫鋰時可以可逆性的返回到初始狀態。這些金屬氧化物作為裡離子電池負極材料表現了較高的可逆容量和能量密度,主要是因為在轉換反應中氧化態得到了充分利用且不止一個電子參與反應。然而,第一次循環時它們的庫倫效率較低,主要與形成的SEI膜不穩定,磁滯現象大和儲存容量較低有關。要解決這些問題,可以制備過渡金屬氧化物的多孔納米材料和過渡金屬氧化物/碳納米復合材料。
對于負極材料,由于高比容量鋰離子電池的巨大市場需求,要求碳質材料不僅具有超高的儲鋰能力,而且能在0 V(vs.Li+/Li) 左右快速可逆地嵌入/ 脫嵌鋰離子。 此外,在提高碳質材料的重量容量的同時,更應重視其體積容量的提高。 因此,在以后的碳質負極材料的研究中,繼續尋找新的碳質材料、新的預處理及復合方法,將是碳質負極材料的研究重點。納米材料技術在鋰離子電池中的應用,將為新型電極材料的研究和開發提供廣闊的空間。
三、結語
鋰離子電池未來發展方向仍是電池容量的提高、改善電極循環壽命、電池的安全性、降低成本。鋰離子電池是繼鎳錫、鎳氫電池后, 市場前景最好, 發展最快的一種二次電池。隨著科學技術的不斷發展, 對正負極材料的研究將有力地推動鋰離子電池的研究和應用, 帶動電動汽車產業的發展和在軍事、航天工業上應用的擴展。
 電子發燒友App
電子發燒友App
























評論