測定電池的放電曲線,是研究電池性能的基本方法之一,根據放電曲線,可以判斷電池工作性能是否穩定,以及電池在穩定工作時所允許的最大電流。本文詳細全面地介紹鋰離子電池放電曲線的基礎知識。由于作者水平有限,文中錯誤之處,歡迎批評指正。
鋰離子電池放電時,它的工作電壓總是隨著時間的延續而不斷發生變化,用電池的工作電壓做縱坐標,放電時間,或容量,或荷電狀態(SOC),或放電深度(DOD)做橫坐標,繪制而成的曲線稱為放電曲線。要認識電池的放電特性曲線,首先需要從原理上理解電池的電壓。
1電池的電壓
電極反應要形成電池必須滿足以下條件:化學反應中失去電子的過程(即氧化過程)和得到電子的過程(即還原反應過程)必須分隔在兩個不同區域中進行,這區別于一般的氧化還原反應;兩電極的活性物質進行氧化還原反應時所需的電子必須由外電路傳遞,這區別于金屬腐蝕過程的微電池反應。電池的電壓是正極與負極之間的電勢差,具體的關鍵參數包括開路電壓、工作電壓、充放電截止電壓等。
1.1鋰離子電池材料的電極電位
電極電位是指固體材料浸于電解質溶液中,顯示出電的效應,即金屬的表面與溶液間產生的電位差,這種電位差稱為金屬在此溶液中的電位或電極電位。簡單說電極電位是表示某種離子或原子獲得電子而被還原的趨勢。
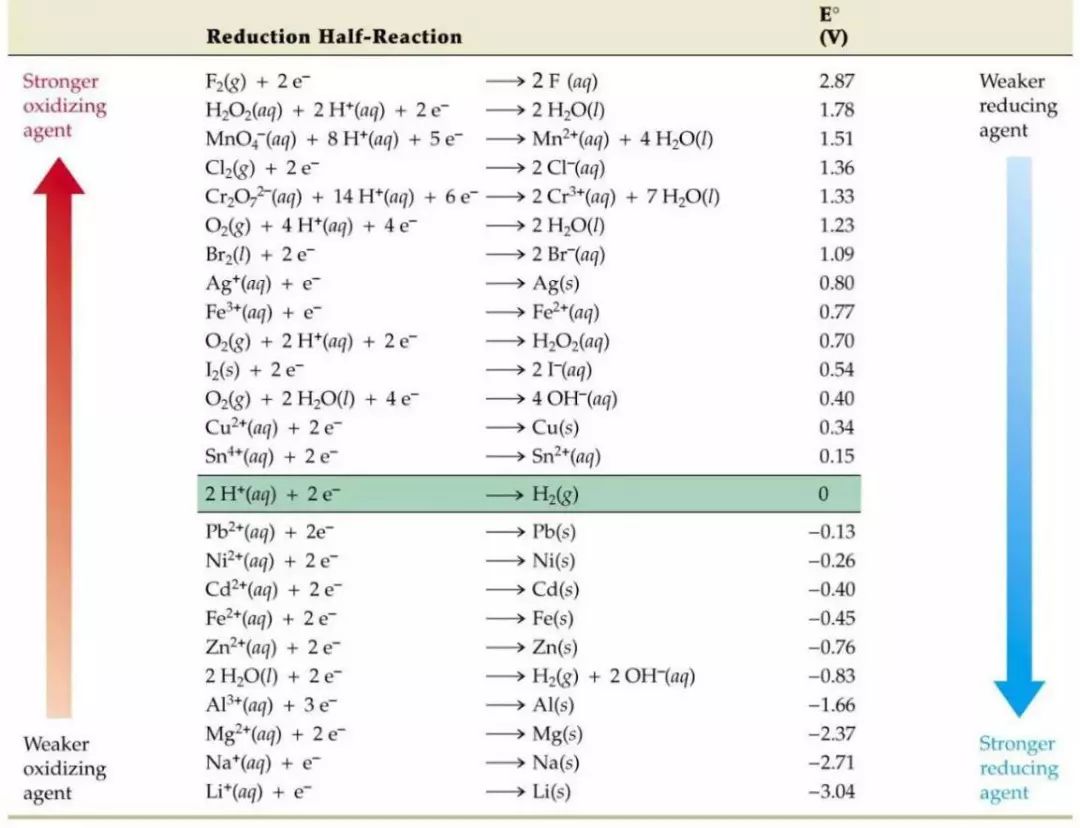
其中,φc即是這種物質表現出來的電極電位。表1中所列的標準電極電勢(25.0℃,101.325kPa)是相對于標準氫電極電勢的值。標準氫電極電勢被規定為0.0V。
表1 常見的材料在水溶液中的標準電極電勢
1.2電池的開路電壓
電池電動勢是根據電池反應,應用熱力學方法進行計算的理論值,即電池在斷路時處于可逆平衡狀態下,正負極之間的平衡電極電勢之差,是電池可以給出電壓的極大值。而實際上,正負極在電解液中并不一定處于熱力學平衡狀態,即電池的正負極在電解質溶液中所建立的電極電勢通常并非平衡電極電勢,因此電池的開路電壓一般均小于它的電動勢。對于電極反應:
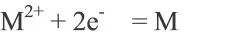
考慮反應物組分的非標準狀態以及活性組分的活度(或濃度)隨時間的變化,采用能斯特方程修正電池實際開路電壓:
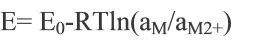
其中,R是氣體常數,T是反應溫度,a是組分活度或濃度。電池的開路電壓取決于電池正負極材料的性質、電解質和溫度條件等,而與電池的幾何結構和尺寸大小無關。
鋰離子電極材料制備成極片,與金屬鋰片組裝成紐扣半電池,可以測得電極材料在不同的SOC狀態下的開路電壓,開路電壓曲線是電極材料荷電狀態的反應,圖1是磷酸鐵鋰電極材料的開路電壓曲線,從開路電壓曲線可以判定電極材料的對應的脫嵌鋰狀態。而電池的開路電壓曲線是正負極材料信息的疊加狀態。
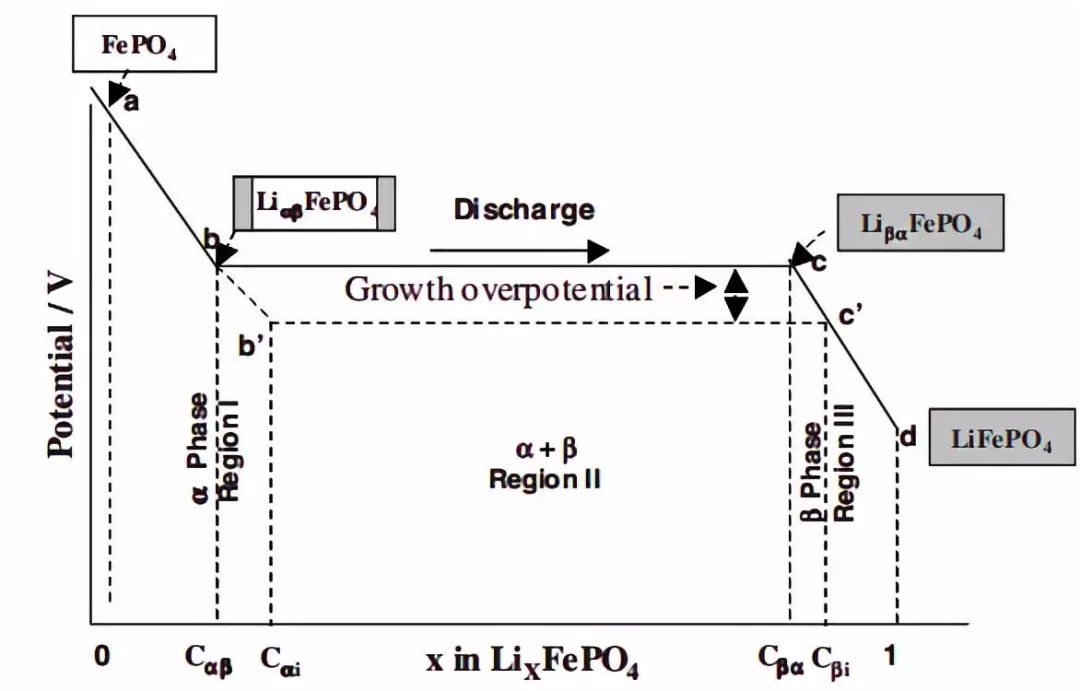
圖1 磷酸鐵鋰電極材料的開路電壓曲線
電池貯存過程中開路電壓會下降,但幅度不會很大,如果開路電壓下降速度過快或幅度過大屬異常現象。 兩極活性物質表面狀態變化及電池自放電是開路電壓在貯存中下降的主要原因,具體包括正負極材料表面膜層的變化;電極熱力學不穩定性造成的電位變化;金屬異物雜質的溶解與析出;正負極之間隔膜造成的微短路等。鋰離子電池在老化時, K值(電壓降)的變化正是電極材料表面SEI膜的形成和穩定過程,如果電壓降太大,說明內部存在微短路,判定電池為不合格品。
1.3電池極化
電流通過電極時,電極偏離平衡電極電勢的現象稱為極化,極化產生過電勢。根據極化產生的原因可以將極化分為歐姆極化、濃差極化和電化學極化,圖2是電池典型的放電曲線及各種極化對電壓的影響。
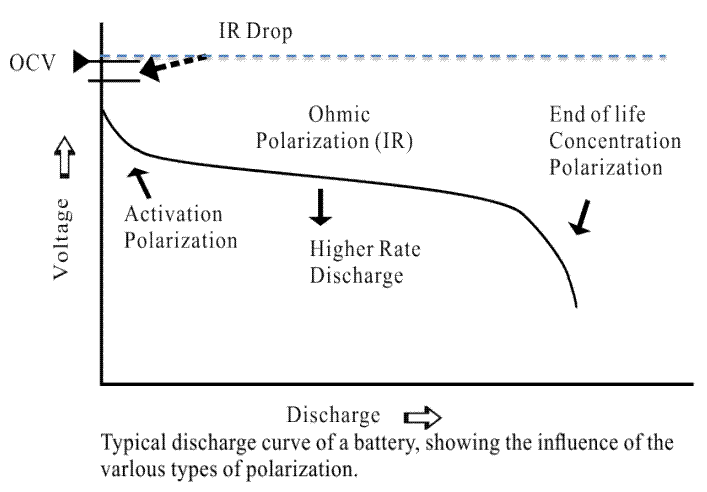
圖2 典型放電曲線及極化
(1)歐姆極化:由電池連接各部分的電阻造成,其壓降值遵循歐姆定律,電流減小,極化立即減小,電流停止后立即消失。
(2)電化學極化:由電極表面電化學反應的遲緩性造成極化。隨著電流變小,在微秒級內顯著降低。
(3)濃差極化:由于溶液中離子擴散過程的遲緩性,造成在一定電流下電極表面與溶液本體濃度差,產生極化。這種極化隨著電流下降,在宏觀的秒級(幾秒到幾十秒)上降低或消失。
電池的內阻隨電池放電電流的增大而增大,這主要是由于大的放電電流使得電池的極化趨勢增大,并且放電電流越大,則極化的趨勢就越明顯,如圖3所示。根據歐姆定律:V=E0-I×RT,內部整體電阻RT的增加,則電池電壓達到放電截止電壓所需要的時間也相應減少,故放出的容量也減少。
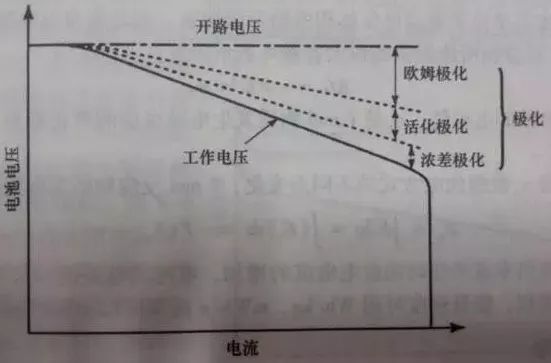
圖3 電流密度對極化的影響
鋰離子電池實質上是一種鋰離子濃差電池,鋰離子電池的充放電過程為鋰離子在正負極的嵌入、脫出的過程。影響鋰離子電池極化的因素包括:
(1)電解液的影響:電解液電導率低是鋰離子電池極化發生的主要原因。在一般溫度范圍內,鋰離子電池用電解液的電導率一般只有0.01~0.1S/cm,,是水溶液的百分之一。因此,鋰離子電池在大電流放電時,來不及從電解液中補充Li+,會發生極化現象。提高電解液的導電能力是改善鋰離子電池大電流放電能力的關鍵因素。
(2)正負極材料的影響:正負極材料顆粒大鋰離子擴散到表面的通道加長,不利于大倍率放電。
(3)導電劑:導電劑的含量是影響高倍率放電性能的重要因素。如果正極配方中的導電劑含量不足,大電流放電時電子不能及時地轉移,極化內阻迅速增大,使電池的電壓很快降低到放電截止電壓。
(4)極片設計的影響:
極片厚度:大電流放電的情況下,活性物質反應速度很快,要求鋰離子能在材料中迅速的嵌入、脫出,若是極片較厚,鋰離子擴散的路徑增加,極片厚度方向會產生很大的鋰離子濃度梯度。
壓實密度:極片的壓實密度較大,孔隙變得更小,則極片厚度方向鋰離子運動的路徑更長。另外,壓實密度過大,材料與電解液之間接觸面積減小,電極反應場所減少,電池內阻也會增大。
(5)SEI膜的影響:SEI 膜的形成增加了電極/電解液界面的電阻,造成電壓滯后即極化。
1.4電池的工作電壓
工作電壓又稱端電壓,是指電池在工作狀態下即電路中有電流流過時電池正負極之間的電勢差。在電池放電工作狀態下,當電流流過電池內部時,需克服電池的內阻所造成阻力,會造成歐姆壓降和電極極化,故工作電壓總是低于開路電壓,充電時則與之相反,端電壓總是高于開路電壓。即極化的結果使電池放電時端電壓低于電池的電動勢,電池充電時,電池的端電壓高于電池的電動勢。
由于極化現象的存在,會導致電池在充放電過程中瞬時電壓與實際電壓會產生一定的偏差。充電時,瞬時電壓略高于實際電壓,充電結束后極化消失,電壓回落;放電時,瞬時電壓略低于實際電壓,放電結束后極化消失,電壓回升。
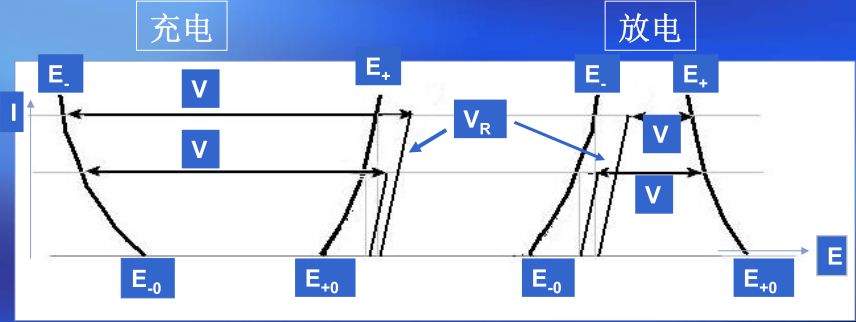
圖4 電池電壓的組成及其與工作電流的關系
綜合以上所述,電池端電壓的組成如圖4所示,表達式為:
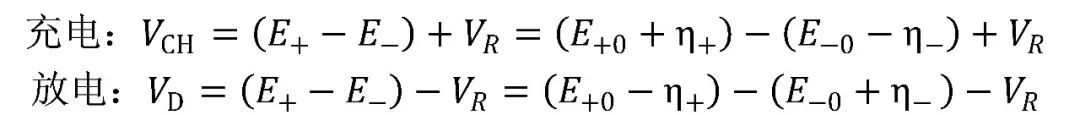
其中,E+、E—分別表示正、負極的電勢,E+0、E—0分別表示正、負極的平衡電極電勢,VR表示歐姆極化電壓,η+、η—分別表示正、負極的過電勢。
2放電測試基本原理
基本了解電池的電壓之后,我們開始解析鋰離子電池的放電曲線。放電曲線基本反映電極的狀態,是正負兩個電極狀態變化的疊加。圖5是常見商業鋰離子電池的典型恒流放電測試的電流和電壓曲線。充放電測試時,設備對電池施加一定的載荷,根據設定的數據記錄條件記錄電壓隨時間的演變過程以及電流隨時間的演變過程。
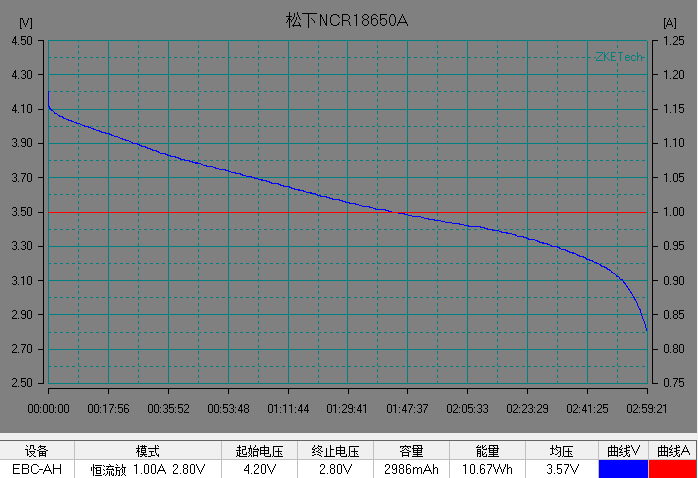
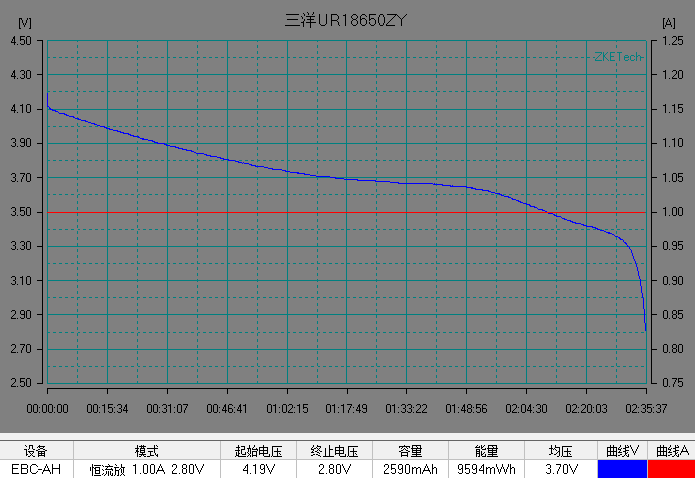
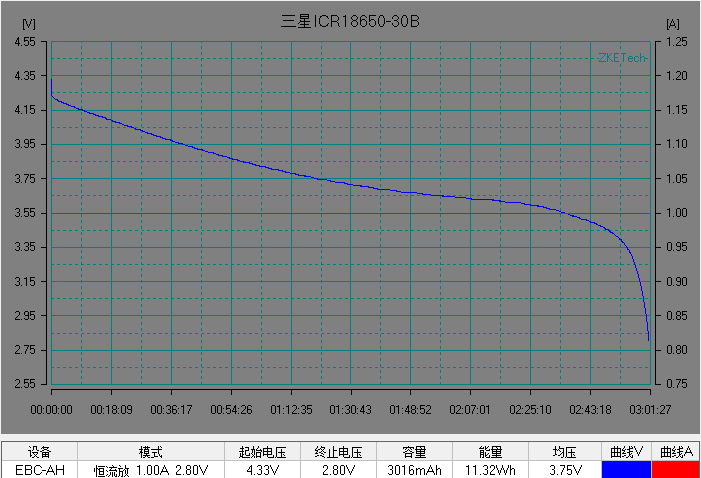
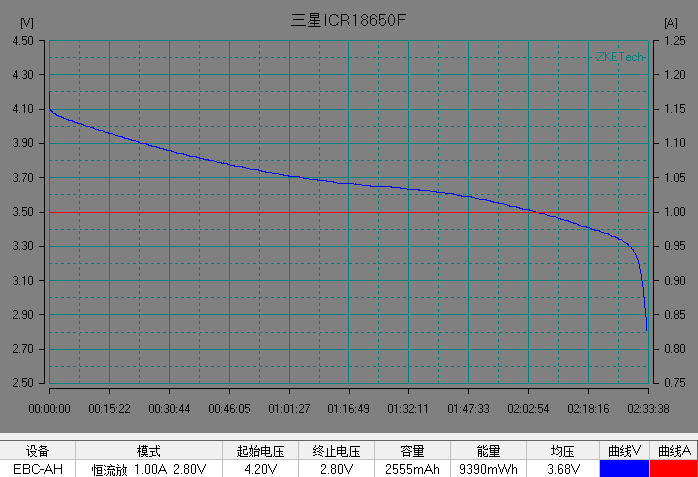
左右滑動查看更多
圖5 常見商業電池的典型放電的電流和電壓曲線。(圖片來源于數碼之家)
在整個放電過程中鋰離子電池的電壓曲線可以分為 3 個階段:
1)電池在初始階段端電壓快速下降,放電倍率越大,電壓下降的越快;
2)電池電壓進入一個緩慢變化的階段,這段時間稱為電池的平臺區,放電倍率越小,平臺區持續的時間越長,平臺電壓越高,電壓下降越緩慢。
3) 在電池電量接近放完時, 電池負載電壓開始急劇下降直至達到放電截止電壓。
測試時,采集數據的方式有兩種:(1)根據設定的時間間隔Δt采集電流,電壓和時間等數據;(2)根據設定電壓變化差ΔV采集電流,電壓和時間數據。充放電設備的精度主要包括電流精度、電壓精度、時間精度。表2是某款充放電機的設備參數,其中,% FS 表示全量程的百分數,0.05%RD是指測量的誤差在讀數的0.05%范圍內。
表2 某款充放電機的設備參數
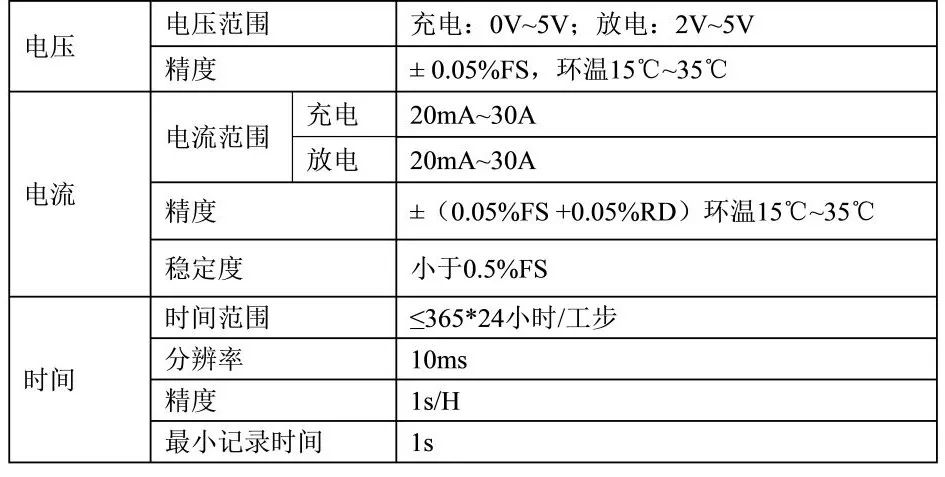
充放電設備一般采用數控恒流源代替負載電阻作負載,使電池的輸出電壓與回路中串聯電阻或寄生電阻無關,而只與電池等效的理想電壓源的電壓E 和內阻r 以及回路電流 I 相關。如果使用電阻做負載,設電池等效的理想電壓源的電壓為E,內阻為 r,負載電阻為R,用電壓表測量負載電阻兩端的電壓,如圖6上圖所示。但是,實際情況下,電路中存在引線電阻和夾具接觸電阻(統一為寄生電阻)圖 6上圖的等效電路圖為圖6下圖所示。實際情況下不可避免地引入了寄生電阻,從而使總的負載電阻變大,但是測量的電壓是負載電阻R 兩端的電壓,因此引入了誤差。
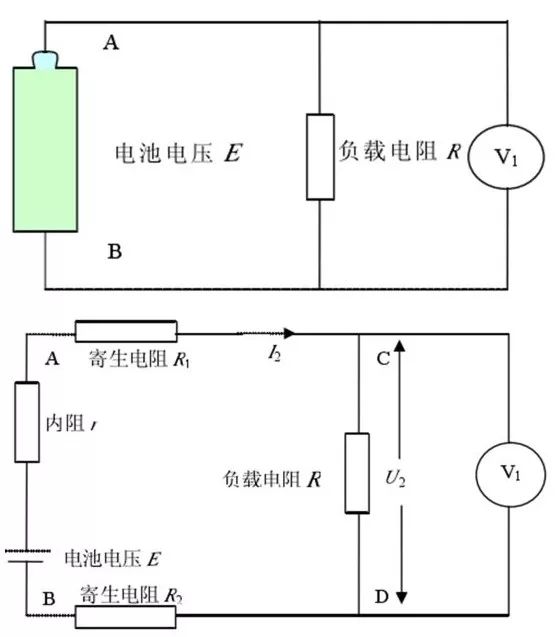
圖6 電阻放電法原理框圖和實際等效電路圖(來源于參考文獻)
當電流為I1的恒流源作為負載時,恒流源負載原理圖和實際等效電路圖如圖7所示。E、I1為恒定值,r在一定時間內不變。
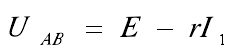
由以上公式可知A、B兩點電壓為恒定值,即電池的輸出電壓與回路中串聯電阻的大小無關,當然也就與寄生電阻無關。另外,四端子測量方式可以實現對電池輸出電壓的較準確測量。
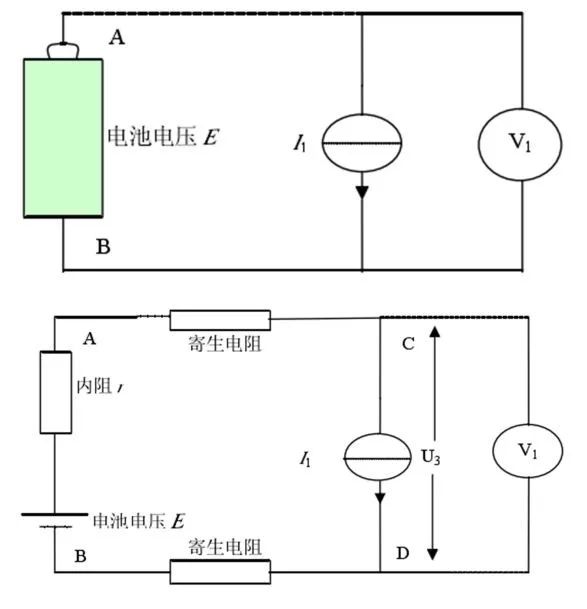
圖7 恒流源負載等效原理框圖和實際等效電路圖(來源于參考文獻)
恒流源是一種能向負載提供恒定電流的電源裝置,在外界電網電源產生波動和阻抗特性發生變化時它仍能使輸出電流保持恒定。
2.1放電測試模式
充放電測試設備一般使用半導體器件作為通流元件,通過調整半導體器件的控制信號,可以模擬出恒流,恒壓,恒阻等多種不同特性的負載。鋰離子電池放電測試模式主要包括恒流放電、恒阻放電、恒功率放電等。在各放電模式下還可以分出連續放電和間隔放電,其中根據時間的長短,間隔放電又可以分為間歇放電和脈沖放電。放電測試時,電池根據設定的模式進行放電,達到設定的條件后停止放電,放電截止條件包括設定電壓截止、設定時間截止、設定容量截止,設定負電壓梯度截止等。電池放電電壓的變化與放電制度有關,即放電曲線的變化還受放電制度的影響,包括:放電電流,放電溫度,放電終止電壓;間歇還是連續放電。放電電流越大,工作電壓下降越快;隨放電溫度的增加,放電曲線變化較平緩。
(1)恒流放電
恒流放電時,設定電流值,然后通過調節數控恒流源來達到這一電流值,從而實現電池的恒流放電,同時采集電池的端電壓的變化,用來檢測電池的放電特性。恒流放電是放電電流不變,但是電池電壓持續下降,所以功率持續下降的放電。圖5就是鋰離子電池恒流放電的電壓和電流曲線。由于用恒電流放電,時間坐標軸很容易轉換為容量(電流與時間的乘積)坐標軸。圖8是恒流放電時電壓-容量曲線。恒流放電是鋰離子電池測試中最常使用的放電方式。
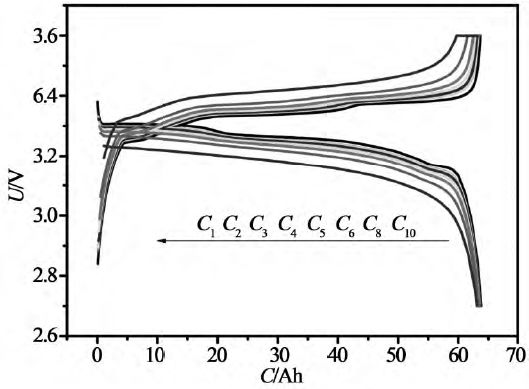
圖8 不同倍率下的恒流恒壓充電、恒流放電曲線(來源于參考文獻)
(2)恒功率放電
恒功率放電時,首先設定恒功率的功率值P,并采集電池的輸出電壓U。在放電過程中,要求P恒定不變,但是U是不斷變化的,所以需要根據公式I = P / U不斷地調節數控恒流源的電流I以達到恒功率放電的目的。保持放電功率不變,因放電過程中電池的電壓持續下降,所以恒功率放電中電流是持續上升的。由于用恒功率放電,時間坐標軸很容易轉換為能量(功率與時間的乘積)坐標軸。圖9是鋰離子電池典型的恒功率充、放電曲線。
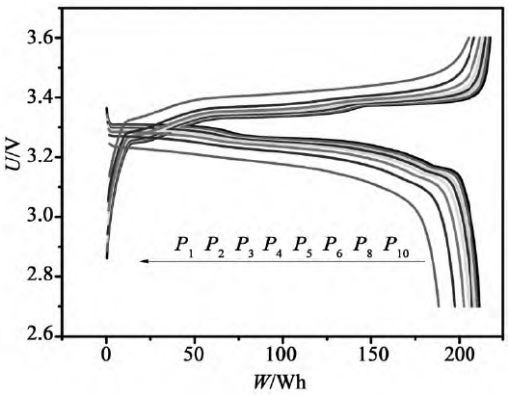
圖9 不同倍率下的恒功率充、放電曲線(來源于參考文獻)
恒流放電和恒功率放電對比[3]
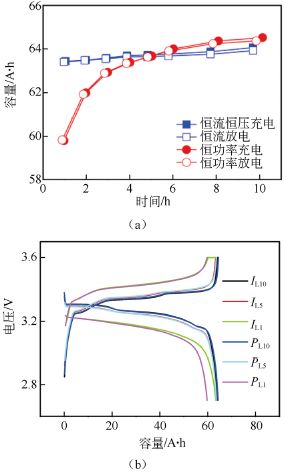
圖10 不同倍率下的(a)充放電容量圖;(b)充放電曲線圖
圖10是磷酸鐵鋰電池兩種模式下不同倍率充放電測試結果。根據圖10(a)的容量曲線,恒流模式下隨著充放電電流的增大,電池實際充放電容量均逐漸變小但變化幅度相對較小。恒功率模式下電池的實際充放電容量也隨功率的增加而逐漸減小,且倍率越大,容量衰減越快。1 h 率放電容量較恒流模式為低。同時,當充放電倍率低于5 h 率時,恒功率條件下電池容量較高,而高于5 h 率時則恒流條件下電池容量較高。
從圖10(b)所示的容量-電壓曲線可以看出,在低倍率條件下,磷酸鐵鋰電池兩種模式容量-電壓曲線接近,且充放電電壓平臺變化不大,但在高倍率條件下,恒流-恒壓模式的恒壓時間明顯加長,且充電電壓平臺明顯升高,放電電壓平臺明顯降低。
(3)恒阻放電
恒阻放電時,首先設定恒定的電阻值R,采集電池的輸出電壓U,在放電過程中,要求R恒定不變,但是U是不斷變化的,所以需要根據公式I=U/R不斷地調節數控恒流源的電流I值以達到恒電阻放電的目的。電池的電壓在放電過程是一直在下降的,電阻不變,所以放電電流I也是一個下降的過程。
(4)連續放電、間歇放電和脈沖放電
電池在恒電流、恒功率和恒電阻三種方式下放電的同時,利用定時功能以實現連續放電、間歇放電和脈沖放電的控制。圖11 是典型脈沖充放電測試的電流曲線和電壓曲線。
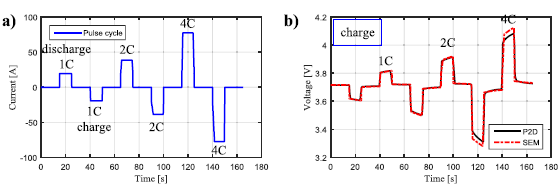
圖11 典型脈沖充放電測試的電流曲線和電壓曲線
2.2放電曲線包含的信息
放電曲線是指放電過程中,電池的電壓、電流、容量等隨時間的變化的曲線。充放電曲線中所包含的信息非常豐富,具體包括容量,能量,工作電壓及電壓平臺,電極電勢與荷電狀態的關系等。放電測試時記錄的主要數據就是電流和電壓的時間演變,從這些基礎數據可以獲取很多參數,以下詳細介紹放電曲線能夠獲取的參數。
(1)電壓
鋰離子電池放電測試中,電壓參數主要包括電壓平臺、中值電壓、平均電壓、截止電壓等。
平臺電壓是指電壓變化最小而容量變化較大時對應的電壓值,可以通過dQ/dV的峰值得出。
中值電壓是電池容量一半時對應的電壓值,對于平臺比較明顯的材料,如磷酸鐵鋰和鈦酸鋰等,中值電壓就是平臺電壓。
平均電壓是電壓-容量曲線的有效面積(即電池放電能量)除以容量,計算公式為ü = ∫U(t)*I(t)dt / ∫I(t)dt。
截止電壓是是指電池放電時允許的最低電壓,如果電壓低于放電截止電壓后繼續放電,電池兩端的電壓會迅速下降,形成過度放電,過放電可能造成電極活性物質損傷,失去反應能力,使電池壽命縮短。
如第一部分所述,電池的電壓與正負極材料的荷電狀態及電極電勢相關。
(2)容量和比容量
電池容量是指一定放電制度下(在一定的放電電流I,放電溫度T,放電截止電壓V條件),電池所放出的電量,表征電池儲存能量的能力,單位是Ah或C。容量受很多引素的影響,如:放電電流、放電溫度等。容量大小是由正負極中活性物質的數量多少來決定的。
理論容量:活性物質全部參加反應所給出的容量。
實際容量:在一定的放電制度下實際放出的容量。
額定容量:指電池在設計的放電條件下,電池保證給出的最低電量。
放電測試中,容量通過電流對時間積分計算,即C = ∫I(t)dt,恒流放電時電流恒定不變,C = ∫I(t)dt = It;恒電阻R放電時,C = ∫I(t)dt = (1/R)*∫U(t)dt ≈ (1/R)*üt(ü為放電平均電壓,t為放電時間)。
比容量:為了對不同的電池進行比較,引入比容量概念。比容量是指單位質量或單位體積電極活性物質所給出的容量,稱為質量比容量或體積比容量。通常計算方法為:比容量=電池首次放電容量 /(活性物質量*活性物質利用率)
影響電池容量的因素:
a.電池的放電電流:電流越大,輸出的容量減少;
b.電池的放電溫度:溫度降低,輸出容量減少;
c.電池的放電截止電壓:是由電極材料以及電極反應本身的限定來設定的放電時一般為3 .0V或2 .75V。
d.電池的充放電次數:電池經過多次充放電后,由于電極材料的失效,電池的放電容量會相應減少。
e.電池的充電條件:充電倍率、溫度、截止電壓等影響充入電池的容量,從而決定放電容量。
電池容量的測定方法:
不同行業根據使用工況,具有不同的測試標準。對于3C產品用的鋰離子電池,根據國標《GB/T18287-2000蜂窩電話用鋰離子電池總規范》,電池的額定容量測試方法為:a)充電:0.2C5A充電;b)放電:0.2C5A放電;c)進行五個循環,其中有一次達到即判定為合格。
對于電動汽車行業,根據國標《GB/T 31486-2015 電動汽車用動力蓄電池電性能要求及試驗方法》,電池的額定容量是指室溫下電池以1I1(A)電流放電,達到終止電壓時所放出的容量(Ah),其中I1為1小時率放電電流,其數值等于C1 (A)。測試方法為:
a)室溫下,以1I1(A)電流恒流充電至企業規定的充電終止電壓時轉恒壓充電,至充電終止電流降至0.05I1(A)時停止充電,充電后擱置1h。
b) 室溫下,電池以1I1(A)電流放電,直到放電至企業技術條件中規定的放電終止電壓;
c) 計量放電容量(以Ah計),計算放電比能量(以Wh/kg計);
d) 重復步驟a)-c)5次,當連續3次試驗結果的極差小于額定容量的3%,可提前結束試驗,取最后3次試驗結果平均值。
(3)荷電狀態SOC
SOC(State of Charge )為荷電狀態,表示在一定的放電倍率下,電池使用一段時間或長期擱置后剩余容量與其完全充電狀態的容量的比值。“開路電壓 + 安時積分”法利用開路電壓法估算出電池初始狀態荷電容量SOC0,然后利用安時積分法求得電池運行消耗的電量,消耗電量為放電電流與放電時間的乘積,則剩余電量等于初始電量與消耗電量的差值。開路電壓與安時積分結合估算SOC 數學表達式為:
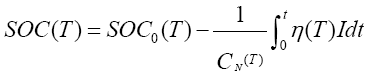
其中,CN 為額定容量;η為充放電效率;T為電池使用溫度;I 為電池電流;t為電池放電時間。
DOD(Depth of Discharge )為放電深度,表示放電程度的一種量度,為放電容量與總放電容量的百分比。放電深度的高低和電池的壽命有很大的關系:放電深度越深,其壽命就越短。兩者關系為SOC = 100%- DOD。
(4)能量和比能量
電池在一定條件下對外作功所能輸出的電能叫做電池的能量,單位一般用wh表示。放電曲線中,能量的計算式為:W = ∫U(t)*I(t)dt。恒流放電時,W = I*∫U(t)dt = It*ü(ü為放電平均電壓,t為放電時間)。
a.理論能量
電池的放電過程處于平衡狀態,放電電壓保持電動勢(E)數值,且活性物質利用率為100%,在此條件下電池的輸出能量為理論能量,即可逆電池在恒溫恒壓下所做的最大功。
b.實際能量
電池放電時實際輸出的能量稱為實際能量,電動汽車行業規定(《GB/T 31486-2015 電動汽車用動力蓄電池電性能要求及試驗方法》),室溫下蓄電池以1I1(A)電流放電,達到終止電壓時所放出的能量(Wh),稱額定能量。
c.比能量
單位質量和單位體積的電池所給出的能量,稱質量比能量或體積比能量,也稱能量密度。單位為wh/kg或wh/L。
2.3放電曲線的基本形式
放電曲線最基本的形式就是電壓-時間和電流時間曲線,通過對時間軸進行變換計算,常見的放電曲線還有電壓-容量(比容量)曲線、電壓-能量(比能量)曲線、電壓-SOC曲線等。
(1)電壓-時間和電流時間曲線
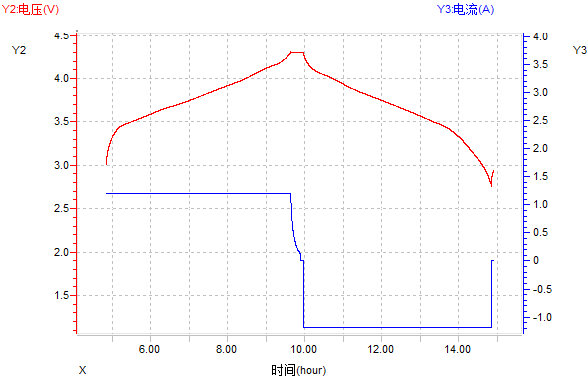
圖12 電壓-時間和電流-時間曲線
(2)電壓-容量曲線
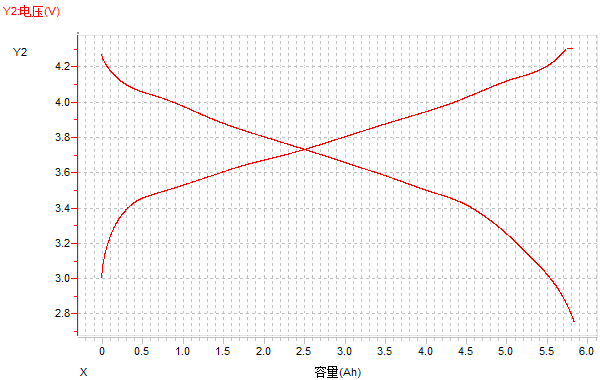
圖13 電壓-容量曲線
(3)電壓-能量曲線
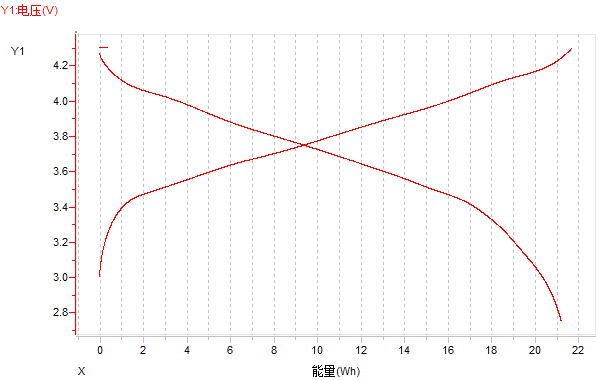
圖14 電壓-能量曲線
3放電曲線的微分處理
充放電曲線中電壓對時間(容量)的變化含有電極過程的信息,但這種變化一般很小,不容易表現出來,對曲線微分可以將變化放大,便于觀察和處理,這對充放電曲線進行微分處理的目的。處理的方法包括:dQ/dV和dV/dQ,常用的方法是對容量或者比容量做微分處理。
相對于參比電極的充放電曲線真實地反映了工作電極的電極過程(三電極體系);相對于金屬鋰電極的充放電曲線近似地反映了工作電極的電極過程(扣式電池);而電池的充放電曲線表現的是正負極電極過程的疊加,因此,電池充放電曲線的微分曲線的峰不能直接確定是反映哪個電極的電極過程。因此,可以通過以下兩種方法處理:
1)紐扣半電池:分別用正、負極與金屬鋰組裝扣式電池,測試充放電曲線,進行微分,分析,圖15為分析實例,詳細解釋見參考文獻【4】;
2)三電極電池:將電池組裝成三電極體系,分別測出正、負極的充放電曲線并微分,圖16是三電極電池正負極和全電池的充放電電壓曲線,可以單獨對正、負極充放電曲線做微分分析;
通過以上方法,再與電池充放電曲線的峰進行對比,以確定與單個電極的電極過程的相應關系。
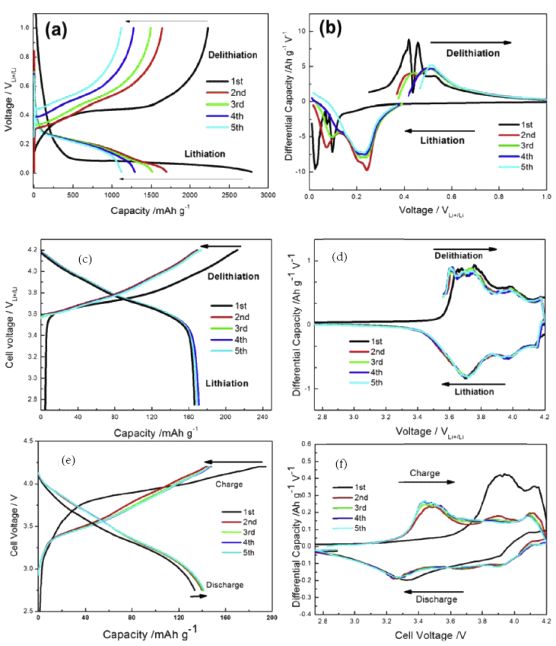
圖15 容量微分分析實例:(a)-(b)硅-石墨烯負極的充放電曲線及比容量微分曲線;(c)-(d)NCA正極充放電曲線及比容量微分曲線;(e)-(f)硅-石墨烯|NCA全電池充放電曲線及比容量微分曲線
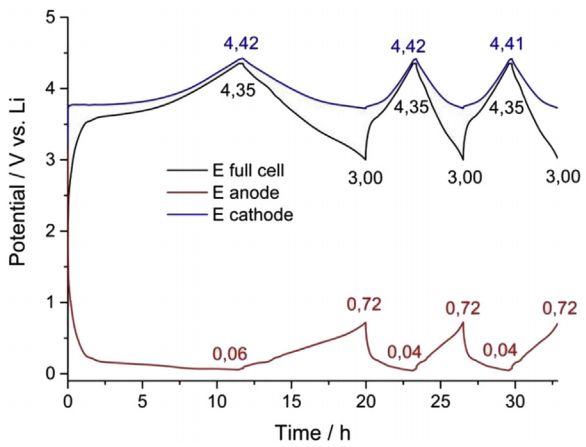
圖16 三電極電池正負極和全電池的充放電電壓曲線
對電壓-容量曲線做微分對原始數據有一定要求,否則無法做出峰值明顯的微分曲線,一般要求等電壓差的電壓、容量數據列。因此,在做充放電測試時,可以設定電壓間隔ΔV=10~50mV來采集數據。或者對原始數據進行篩選,圖17新威充放電設備數據篩選界面。
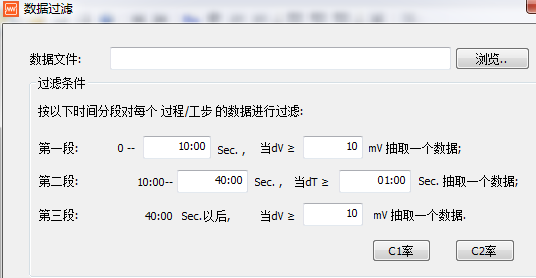
圖17 新威充放電設備數據篩選界面
另外,利用Excel也可以實現數據的篩選,具體篩選方法如下(本部分內容由網友霞光萬道整理):
1)將電壓、容量的原始數據復制到excel表中A、B列,如圖18所示。
2)將A列的第一個電壓數據復制到D2列并選中,點擊編輯欄中的“填充”,出現一對話框,選擇“列”,填寫“步長值”和“最大值”后,點擊確定,如圖18所示生成D列電壓數據。
3)點擊E2,輸入公式=vlookup(D2,A:B,2,TRUE),按回車,下拉菜單或雙擊,數據篩選完成。
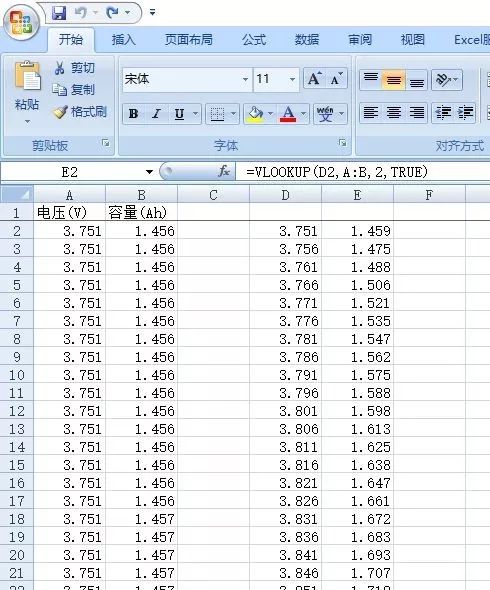
圖18 Excel實現數據的篩選
篩選完成的數據導入origin軟件中。然后,容量選為y軸,電壓選為x軸,然后再執行analysis—mathematics—differentiate操作,會發現數據表格中多出一列數據,這就是dQ/dV值,再以它為y軸,電壓為x軸作圖,即可得到dQ/dV曲線。
容量微分分析示例
圖19是幾種負極材料無定形炭、硅、二氧化硅、一氧化硅材料前兩次充放電循環的容量微分曲線【6】。圖19(a)是無定形炭材料前兩次充放電循環的容量微分曲線。由圖可知,無定形炭材料在前兩次放電過程主要嵌鋰峰的峰值電壓均小于0.1 V,與之對應的是在充電曲線中出現峰值電壓為0.2 V的脫鋰峰。該無定形碳材料在電勢>0.1 V的區間內幾乎沒有觀察到明顯的還原峰。
圖19(b)是無定形硅負極材料在前兩次充放電循環中的容量微分曲線。由圖可知,無定形硅在首次放電過程中存在一個電勢為0.1~0.2 V的強烈的嵌鋰峰,與之對應的是在充電過程中電勢為0.42 V的強烈的脫鋰峰;從第二次充放電循環開始,硅負極材料顯示兩個不同的還原氧化峰對,其還原電勢分別0.06和0.21 V,對應的是鋰離子同硅合金化反應形成LixSi
中間態的過程。
圖19(c)是無定形二氧化硅負極材料第二次充放電循環的容量微分曲線。由圖可知,無定形二氧化硅材料的第二次放電過程的存在兩個不同的還原峰,分別位于0.17和0.06V,與之對應的是在充電過程位于0.32V和0.46V的氧化峰。這兩個還原-氧化峰對分別對應于鋰離子同SiO2結構作用形成Li2Si2O5和單晶硅,以及鋰離子同單晶硅作用形成LixSi合金的過稱。
圖19(d)是無定形一氧化硅材料第二次充放電循環的容量微分曲線。由圖可知,無定形一氧化硅材料在第二次放電過程中存在兩個電勢分別為0.1和0.2V的還原峰,與之對應的是電勢為0.27和0.46 V的兩個氧化峰。一氧化硅負極材料的結構包含[SiSi4]微區和SiO2微區,這兩對氧化還原峰對應的是這兩種微區結構同鋰離子的作用。
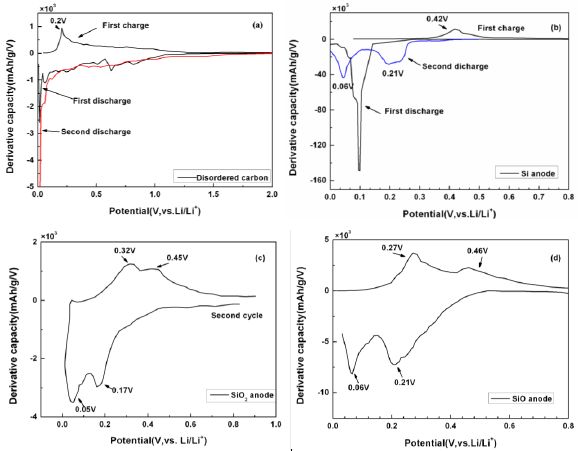
圖19 幾種負極材料(a)無定形炭、(b)硅、(c)二氧化硅、(c)一氧化硅材料前兩次充放電循環的容量微分曲線
后記:
本文在6月初開始列出提綱,主要在每天清晨(5:00-7:00)整理撰寫,先收集了大量資料,包括文獻、網絡資源,整理撰寫歷時一個月。在這個過程中,自己也是一個學習的過程。鋰電池是一個系統性的工程,即使一個放電曲線,里面就包含了太多的知識。本來列出的提綱,還包括放電測試(倍率放電、溫度特性、工況測試等)、充放電曲線常見異常情況。但是,發現越寫內容越多,實在很難在一篇文章中完整介紹。另本人的個人公眾號:鋰想生活(LIB-Life),整理分享鋰電技術文章,歡迎大家關注。點擊文章開頭或者結束處的作者賬戶(mikoWoo LIBLife),里面收集了大部分原創文章。最后,歡迎大家閱讀、轉發,本文已開放轉載,公眾號可以自由轉載,轉載請保留后記部分,并注明本文來源:鋰想生活(LIB-Life),作者:miko woo。
參考文獻:
[1] 岳禮仁. 電池放電系統的相關技術研究[D]. 寧波大學, 2012.
[2] 郭繼鵬等. 磷酸鐵鋰電池恒流和恒功率測試特性比較[J]. 蓄電池. 2017(03): 109-115.
[3] 王超等. 電化學儲能器件恒流與恒功率充放電特性比較[J]. 儲能科學與技術. 2017(06): 1313-1320.
[4] Eom K S, Joshi T, Bordes A, et al. The design of a Li-ion full cell battery using a nano silicon and nano multi-layer graphene composite anode[J].
[5] Marinaro M, Yoon D, Gabrielli G, et al. High performance 1.2 Ah Si-alloy/Graphite|LiNi0.5Mn0.3Co0.2O2 prototype Li-ion battery[J]. Journal of Power Sources. 2017, 357(Supplement C): 188-197.
[6] 劉相. 高容量C/Si-O-C負極材料的制備及其嵌脫鋰離子機理的研究[D]. 國防科學技術大學, 2012.
-
鋰電池
+關注
關注
260文章
8175瀏覽量
171198
原文標題:鋰電池放電曲線全面解析
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 鋰離子電池放電曲線基礎知識詳解
鋰離子電池放電曲線基礎知識詳解










評論