細菌療法已成為腫瘤免疫治療的未來發展方向之一。包括嵌合抗原受體T細胞免疫療法(CAR-T)和溶瘤病毒在內的人工生物系統療法已取得顯著的臨床治療效果,多款產品已獲批上市。作為人工生物系統療法的重要組成部分,腫瘤細菌療法的多項II期和III期臨床試驗正在開展當中,有望取得下一代突破性臨床進展。傳統的第一代細菌療法利用天然細菌發揮抗腫瘤作用,如FDA批準的治療膀胱癌的卡介苗(BCG),雖然具有較好的治療效果,但是細菌的毒性阻礙細菌療法的進一步應用。
隨著分子生物學技術的快速發展,第二代細菌療法通過基因工程改造增強細菌的抗腫瘤功能、或者敲除毒力因子獲得減毒細菌,極大提高其治療效果和安全性。隨著納米技術的迅速發展,借助功能化的納米材料輔助細菌療法,構建“細菌-納米材料雜合系統”,已發展成為更加安全、強效、智能的第三代細菌療法。腫瘤靶向菌基因表達的精準控制是細菌療法安全性和有效性的基礎,然而目前仍缺少有效的精準操縱手段。
近期,國家納米科學中心聶廣軍/趙瀟課題組在Nature Communications上發表題為“Modular-designed engineered bacteria for precision tumorimmunotherapy via spatiotemporal manipulation by magnetic field”的研究。該研究借助磁性納米材料的磁熱效應,創新實現交變磁場對體內細菌基因表達和藥物釋放行為的時間-空間精準操縱。
通過這種交變磁場介導的基因操縱系統,可以實現腫瘤靶向菌在腫瘤部位的裂解,以及CD47阻斷藥物的精準可控釋放,有效降低CD47的血液毒性;同時,細菌裂解物通過I型干擾素通路能夠顯著增強CD47阻斷藥物的療效,最終實現腫瘤的精準免疫治療。
腫瘤細胞表面高表達的CD47蛋白作為“別吃我”信號,可以幫助腫瘤細胞逃逸巨噬細胞的清除,以CD47抗體為代表的吞噬檢查點藥物展示出較好的抗腫瘤治療效果。然而,CD47廣泛表達于幾乎所有的正常組織細胞,是細胞表面一個重要的“自我”標記,尤其是自體免疫細胞識別紅細胞的重要標志物,CD47抗體的全身給藥容易導致較為嚴重的血液毒性。該研究借助磁場操縱的腫瘤靶向菌實現CD47阻斷藥物在腫瘤的特異性釋放,有效避免其血液毒性。
細菌療法通過基因改造的腫瘤靶向菌分泌的治療性藥物發揮抗腫瘤效應。靜脈注射后,雖然腫瘤靶向菌主要定植在腫瘤部分,在正常的組織器官無法長期存活,但是仍可能有少量細菌定植在特定的正常組織器官,例如,肝臟、脾臟、缺氧干細胞龕等。因此,腫瘤靶向菌的基因表達和藥物釋放行為需要時空精準控制,防止藥物在正常組織器官的釋放以引起嚴重的副作用。該研究借助交變磁場實現藥物的時空精準釋放,通過控制磁場的施放時間和強度,這種時空精準控制可以及時調整給藥劑量和時間間隔。例如,在治療效果較差時增加給藥次數、縮短給藥間隔;或在副作用較高時及時降低給藥劑量。
傳統基因工程改造菌的誘導型啟動子是控制細菌基因表達最常用的策略,然而無論是利用腫瘤微環境敏感型啟動子(如缺氧、微酸響應型啟動子),還是外源誘導劑響應型啟動子(如阿拉伯糖響應型啟動子),很難實現對體內細菌基因表達的精準操縱。近年來,近紅外光已被用于基因表達操縱,然而有限的組織穿透能力限制了深部腫瘤的應用。作為理想的操縱手段,磁場具有優良的腫瘤組織穿透能力、安全性和非侵入性,但是借助傳統的基因工程技術難以實現磁場對細菌基因表達的操縱。
因此,研究人員提出利用磁性Fe?O?納米材料在交變磁場中的磁熱效應實現腫瘤靶向菌基因表達的時空操縱。首先,利用基因工程和納米技術對工程菌進行模塊化設計和制造(圖1A),這種模塊化設計可以方便后續的功能評價和性能優化。與工業機器人類似,磁控工程菌系統由五個功能模塊組成,其中包括“主動導航”、“信號解碼”、“信號反饋”、“信號處理”和“信號輸出”五個模塊。
“主動導航”模塊對應工程菌的腫瘤靶向單元,借助ClyA蛋白展示系統將靶向分子HlpA展示在細菌外膜表面,靶向腫瘤細胞高表達的硫酸乙酰肝素糖蛋白(HSPG);“信號解碼”模塊對應磁熱轉化單元,修飾在腫瘤靶向菌表面的順磁性Fe?O?納米顆粒能夠接收磁場信號并將其轉化為42℃的熱量;
“信號反饋”模塊對應熱敏熒光成像,磁熱導致熒光分子Cy5和淬滅伴侶分子BHQ3的共釋放,實現磁熱激活的熒光活體成像監測;“信號處理和輸出”模塊對應蛋白表達和藥物釋放,在熱敏啟動子的控制下,磁熱激活工程菌質粒中裂解蛋白的表達,實現工程菌的裂解和藥物蛋白(抗CD47納米抗體)的釋放(圖1B)。
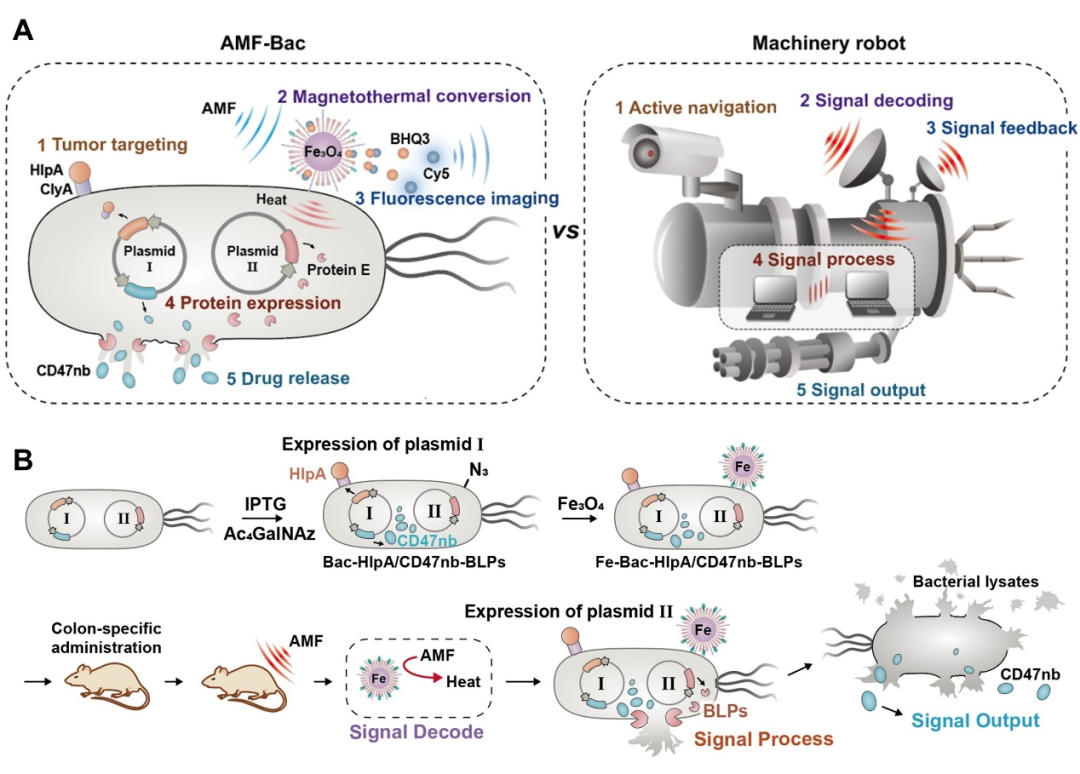
圖1 磁場精準操縱的腫瘤靶向菌的模塊化結構、工作原理和構建流程(圖源:Nature communications)
該工作發現并闡明磁控工程菌裂解物的強大免疫原性能夠有效激活抗原提呈細胞(APC)的I型干擾素通路,增強APC的抗原提呈能力。與此同時,磁控釋放的CD47納米抗體能夠增加APC對腫瘤抗原的攝取,因此,工程菌裂解物與CD47阻斷療法能夠產生顯著的協同抗腫瘤效應,將CD47“別吃我”信號介導的天然免疫強化為CD8+ T細胞介導的適應性抗腫瘤免疫反應,對原位結腸腫瘤以及遠端腫瘤產生強大的抗腫瘤作用(圖2)。
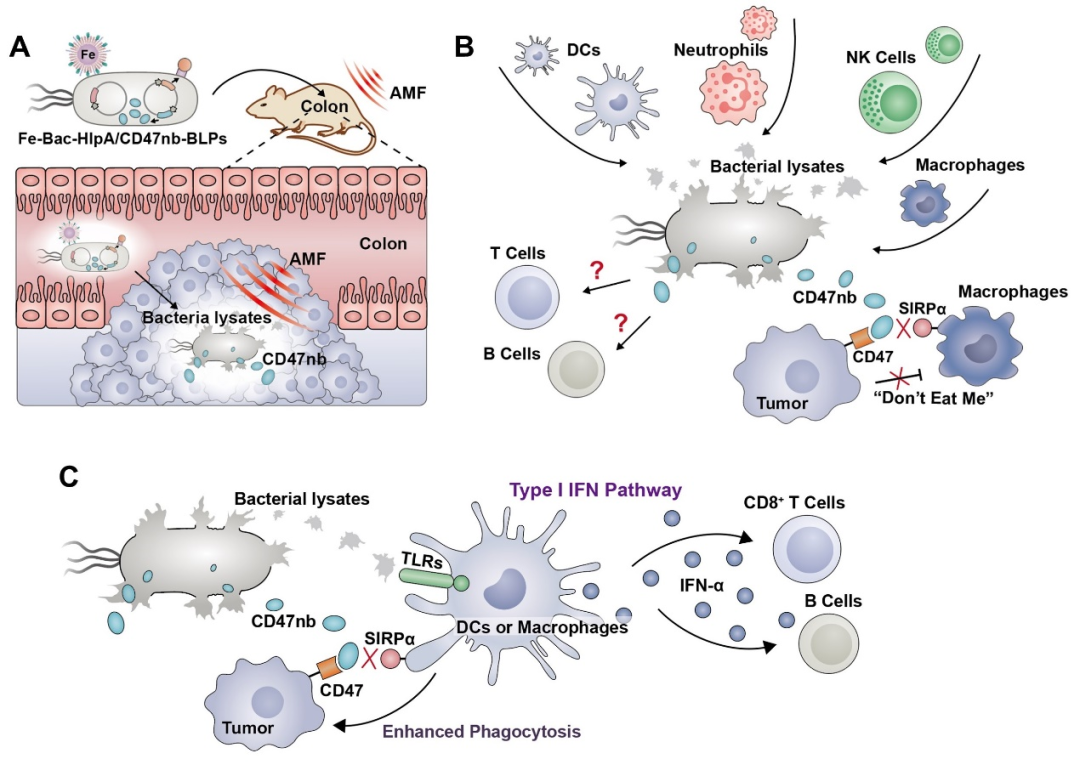
圖2 磁控工程菌激活I型干擾素途徑和CD8+ T細胞介導的適應性免疫(圖源:Nature communications)
目前的多項臨床試驗結果表明,腫瘤靶向菌只能在部分患者的腫瘤內部定植,如何提高定植率成為限制細菌療法的關鍵科學問題。相比于腫瘤靶向菌基因表達操縱的其他手段,該研究開發的磁控系統能夠實現恒定磁場對細菌運動方向的控制,顯著增加細菌的腫瘤靶向定植數量,展示出磁場操縱的顯著優勢(圖3)。該研究表明,恒定磁場和交變磁場可以貫序結合使用。給藥后,先借助恒定磁場提高工程菌在腫瘤的定植數量,再借助交變磁場操縱工程菌的基因表達和藥物釋放,這種貫序結合能夠顯著提高治療效果,對400 mm3以上的大腫瘤也可以發揮較好的治療效果。
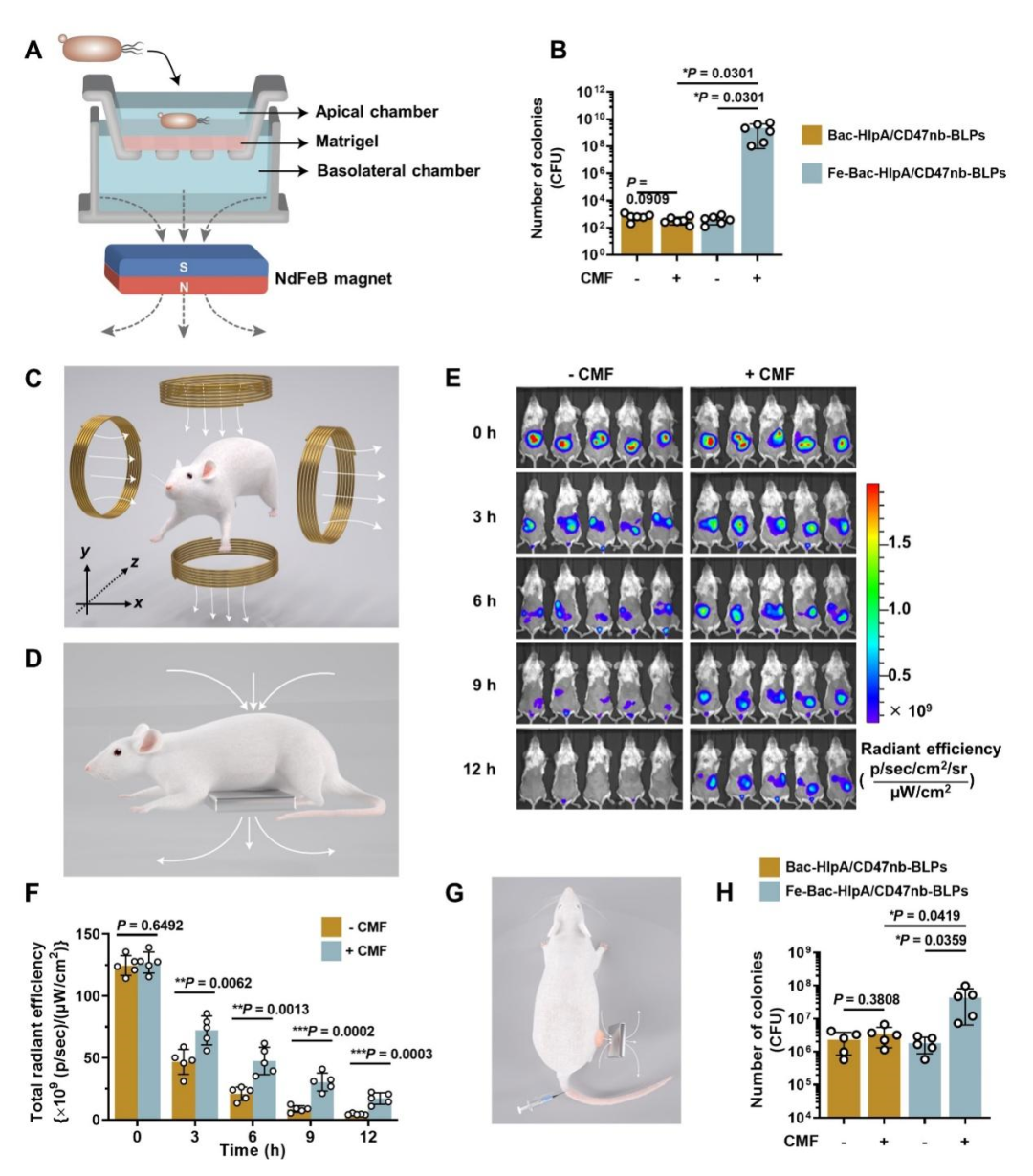
圖3 恒定磁場控制工程菌運動方向以提高腫瘤定植數量(圖源:Nature communications)
綜上所述,該研究將磁熱效應用于腫瘤靶向菌基因表達的精準操縱,這種操縱方法的突出優勢不僅在于磁場的安全性和深層組織穿透性,更在于恒定磁場和交變磁場的貫序使用,實現運動行為操縱和基因表達操縱的有機結合。對當前材料的某些升級可以改善其性能,例如,載荷的抗CD47納米抗體也可以被其他免疫治療藥物取代從而實現不同的治療目的(如免疫檢查點抑制劑PD-L1和CTLA-4),進而實現其他藥物的腫瘤靶向遞送、增強療效并降低毒性。細菌裂解物可以增加免疫細胞浸潤,將“冷腫瘤”轉化為“熱腫瘤”,并激活I類干擾素信號通路,因此,細菌裂解物引起的免疫反應可能與這些免疫藥物協同,進一步增強其療效。這種細菌-納米材料雜合系統為腫瘤免疫治療策略提供了提供了新的機遇,同時也將推動細菌療法用于癌癥治療的進一步探索。
審核編輯:劉清
-
APC
+關注
關注
0文章
36瀏覽量
11526 -
FDA
+關注
關注
0文章
76瀏覽量
18351 -
BCG技術
+關注
關注
0文章
3瀏覽量
5076
原文標題:模塊化設計的磁控工程細菌,實現腫瘤精準免疫治療
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
原理圖模塊化,BOM 物料位號處理
模塊化示波器的技術原理和應用
模塊化儀器的技術原理和應用場景
浪潮信息存儲系統助力甘肅省武威腫瘤醫院精準放療
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
即插即用DAQ設備與模塊化DAQ系統的概念解析

模塊化插座接線方法有哪些
安波福模塊化連接器的優勢
實戰分享:腫瘤電場治療硬件設計方案

為什么模塊化配線架越來越受歡迎?
機房升級必備神器:模塊化精密空調的五大超能力!





 模塊化設計的磁控工程細菌實現腫瘤精準免疫治療
模塊化設計的磁控工程細菌實現腫瘤精準免疫治療











評論