前列腺癌是男性最常見的腫瘤疾病,其治療在標準腫瘤治療中仍然是一大挑戰。磁驅動微型機器人在現代納米醫學中,具有無線引導、有效細胞穿透和非侵入性驅動的優勢。
近期,來自捷克布爾諾理工大學(Brno University of Technology)的Martin Pumera團隊報道了用于原位治療前列腺癌的新型可生物降解磁驅動含鋅與胱氨酸微型機器人。
在該研究中,微型機器人是基于可生物降解的胱氨酸微粒,通過簡單的鋅介導的自組裝方法獲得。同時,鐵磁性能由Fe?O?納米顆粒(NPs)引入,從而允許可控的磁導航。
胱氨酸微型機器人可以在腫瘤細胞附近遞送并自然吸收,細胞內還原環境可引起胱氨酸二硫鍵的斷裂,自發生物降解。因此,Zn2?作為治療前列腺癌(PC)的必需金屬離子,可以在細胞內釋放,促進癌細胞的殺傷(方案1)。
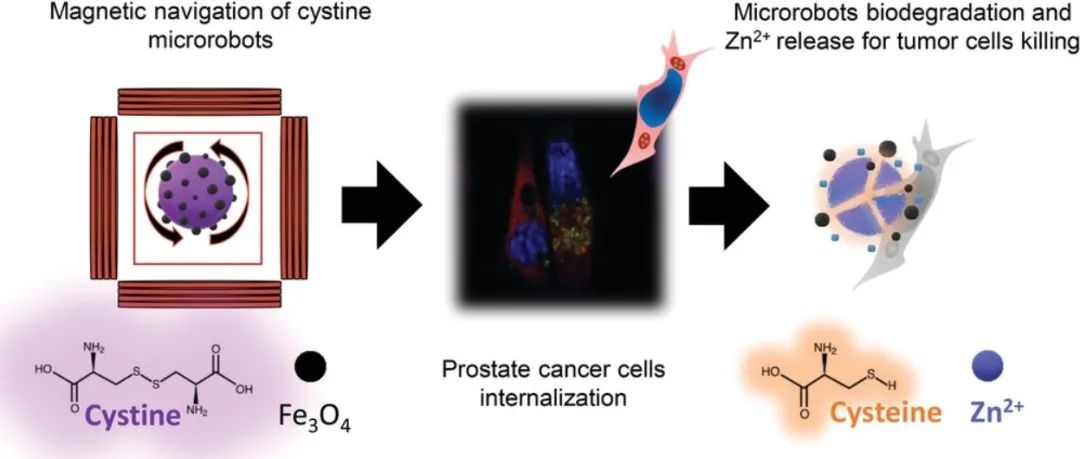
方案1磁驅動胱氨酸微型機器人被遞送到前列腺癌(PC)細胞附近并被細胞吸收,細胞內還原環境通過破壞二硫鍵和非共價分子間相互作用對微型機器人進行生物降解,導致Zn2?的釋放,從而促進腫瘤細胞的殺傷
圖1報告了制備胱氨酸微粒和相應的胱氨酸微型機器人的方案,以及掃描電子顯微鏡(SEM)圖像和能量色散X射線光譜(EDX)圖像,可以觀察到胱氨酸微型機器人具有更高的表面粗糙度和較低的致密結構(圖1a)。
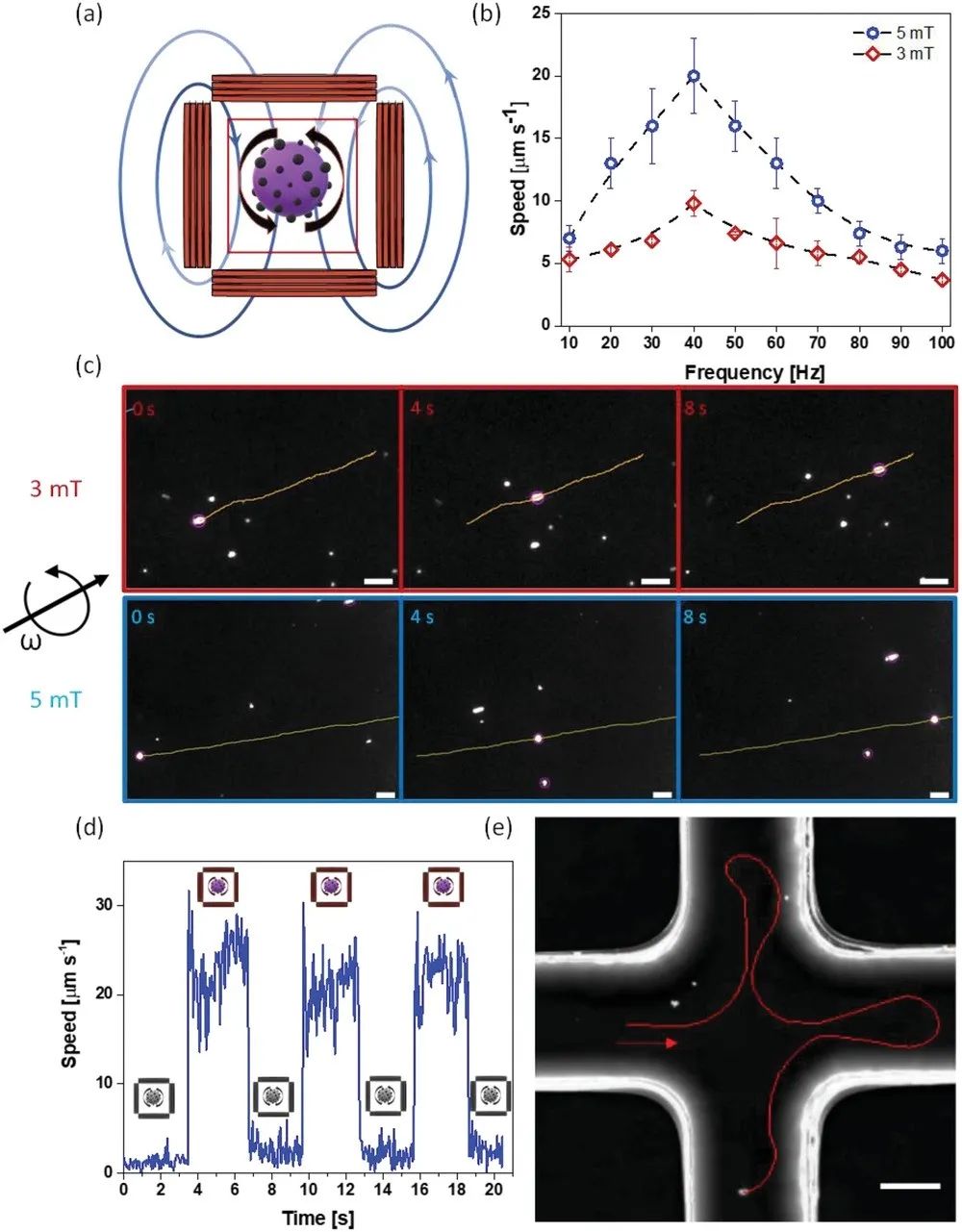
圖1胱氨酸微粒及磁性胱氨酸微型機器人的制備與形態分析
研究人員使用旋轉磁場來操縱微型機器人,圖2a顯示了磁性設置的示意圖,圖2b報告了微型機器人的速度與施加磁場的頻率和強度之間的關系。圖2c顯示了捕獲的延時光學顯微鏡圖像,證實了施加的磁場強度與胱氨酸微型機器人的位移之間的相關性。通過打開或關閉磁場來研究精準控制(圖 2d),在沒有磁場的情況下,微型機器人僅呈現布朗運動,而當打開磁場時產生即時響應。此外,微型機器人通過預定義的路徑導航到微流體通道,顯示遠程良好控制的導航性(圖2e)。

圖2磁驅動胱氨酸微型機器人運動分析
胱氨酸在細胞中會迅速轉化為半胱氨酸。為了證明胱氨酸微型機器人的有效酶還原,使用還原煙酰胺腺嘌呤二核苷酸(NADH)為模型來探索其生物降解。圖3a報告了胱氨酸的NADH還原,從圖3b中報告的紫外-可見光譜中的吸收峰強度變化,證實了反應的發生。
當使用動態光散射(DLS)確定胱氨酸微型機器人的尺寸分布(圖3c),發現胱氨酸微型機器人逐漸自我降解。微型機器人具有出色的尺寸穩定性(圖3d)。當用純水處理時(圖3e),它們表現出高度的聚集。綜上所述,胱氨酸微型機器人在模擬生物環境中表現出良好的穩定性。
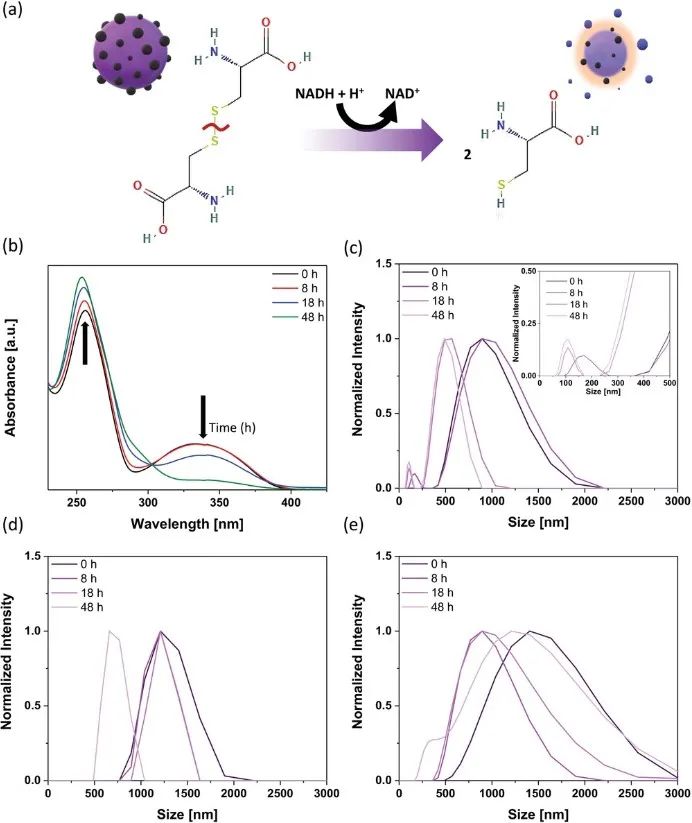
圖3胱氨酸微型機器人酶轉化
圖4報告了PC-3細胞的微分干涉對比(DIC)和熒光顯微鏡圖像,以驗證胱氨酸微型機器人的內化。圖4a中的圖像表明胱氨酸微型機器人在細胞中內化。圖4b中報告的Z-stacks圖像正交投影的構建通過觀察微型機器人定位后的熒光圖像的重疊來進一步支持定位。
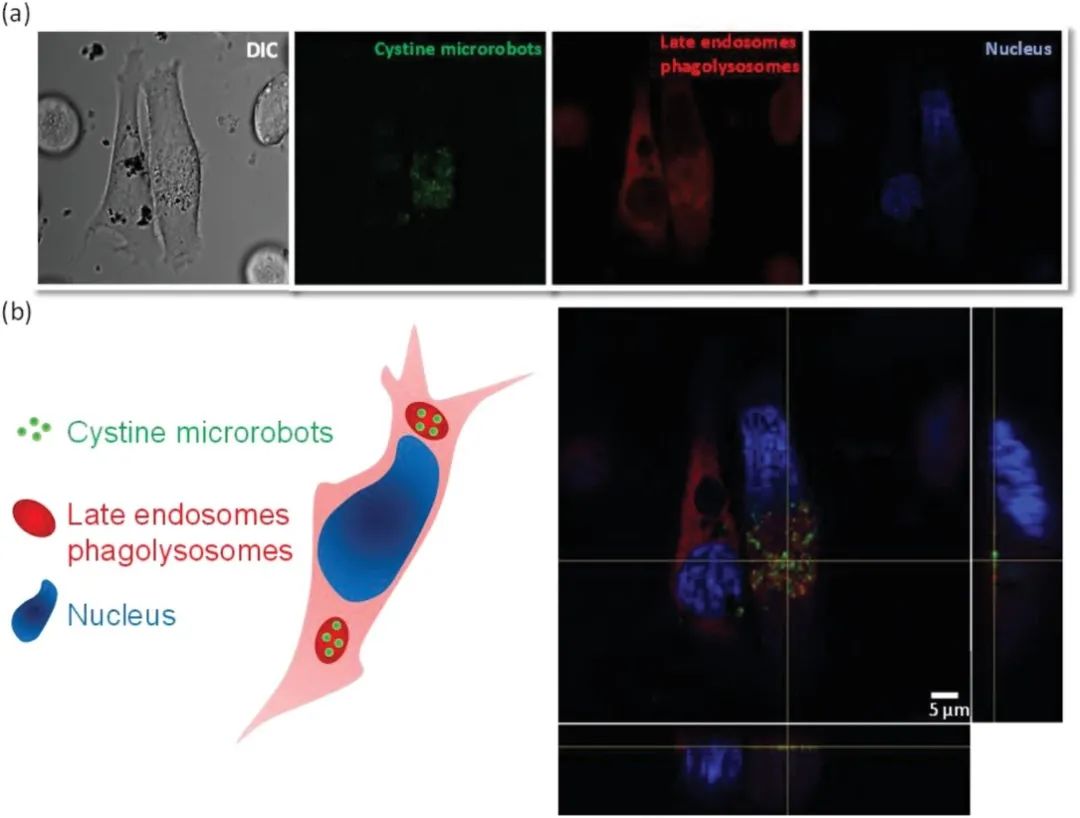
圖4PC-3細胞對胱氨酸微型機器人攝取的評估
用胱氨酸微型機器人和胱氨酸微粒孵育PC-3細胞后,通過實時監測細胞增殖和死亡,研究細胞毒性作用。用胱氨酸微型機器人處理細胞的活力百分比(圖5a),隨著使用濃度增加而降低,并且產生半細胞生長抑制的濃度低于胱氨酸微粒(圖5b)。
通過實時成像(圖5c),在存在胱氨酸微型機器人的情況下顯示出更高的細胞增殖減少。因此,胱氨酸微型機器人顯示出比胱氨酸微粒更高的細胞毒性。可能是添加Fe?O? NPs后微粒形態的急劇變化(圖5d),有利于Zn2?的釋放。
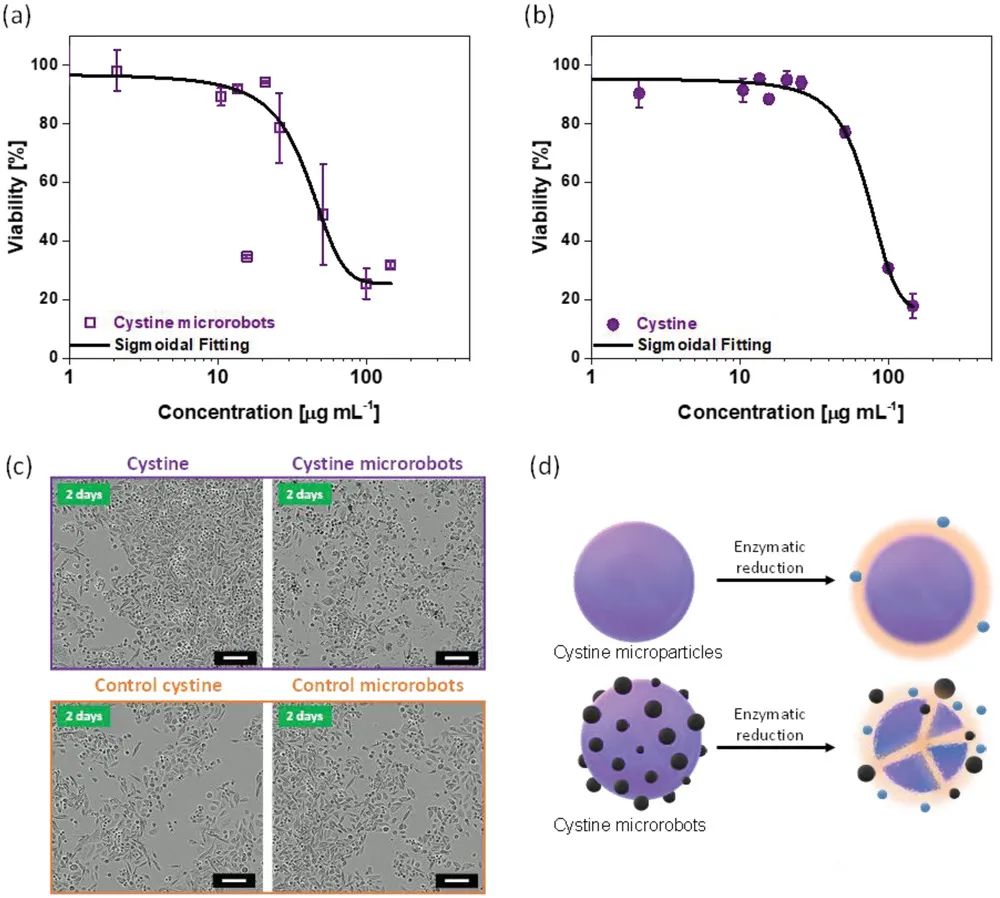
圖5胱氨酸微型機器人對活PC-3細胞的細胞毒性作用
本文介紹的處理PC細胞的有效策略是基于氨基酸胱氨酸的新型自降解磁驅動微型機器人,并可以通過鋅介導的自組裝方法制造,表征結果證實了這種新型微型機器人,可以通過內化方式以非侵入性方法殺死腫瘤細胞,在將來有望用于PC治療。
審核編輯:劉清
-
機器人
+關注
關注
211文章
28445瀏覽量
207202 -
SEM
+關注
關注
0文章
222瀏覽量
14447 -
永磁驅動器
+關注
關注
0文章
2瀏覽量
1214 -
DLSS
+關注
關注
0文章
22瀏覽量
3088
原文標題:磁驅動自降解微型機器人,用于前列腺癌治療
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
【「具身智能機器人系統」閱讀體驗】2.具身智能機器人大模型
【「具身智能機器人系統」閱讀體驗】1.初步理解具身智能
基于漩渦湍流輔助的微流控平臺,可實現類精子結構的微型機器人一步成型

機器人的 “眼睛”——MT6816 磁編碼 IC 的智能除草機器人

MT6825 磁編碼 IC 賦能智能耕種機器人的技術密碼
深度剖析:MT6816 磁編碼 IC 在機器人焊接變位機中的應用

Al大模型機器人
捷克研發微型機器人,捕獲水中塑料廢物及細菌
用于機器人化血管栓塞的磁性柔性微纖維機器人研究




 磁驅動自降解微型機器人用于前列腺癌治療
磁驅動自降解微型機器人用于前列腺癌治療












評論