發(fā)展性能優(yōu)良的高特異、高內(nèi)涵靶向分子是實現(xiàn)活體化學(xué)測量的基礎(chǔ),也是現(xiàn)代分析化學(xué)領(lǐng)域的前沿。與其它類型的識別分子相比,具有內(nèi)源活性的靶向多肽具有更高的信息量和更好的生物相容性。因此,靶向多肽在體內(nèi)分子精準靶向方面具備獨特優(yōu)勢,是有力的活體測量識別工具。然而,目前對于靶向多肽的獲取方法有限,常規(guī)分子篩選和分子進化手段難以在篩選效率、篩選精度、多肽性能構(gòu)象等方面獲得突破。因此,亟待靶向多肽篩選新策略。
基于上述問題,近日,北京理工大學(xué)王蔚芝課題組與新加坡國立大學(xué)陳小元課題組合作,開發(fā)了基于微流控芯片的靶向多肽分子多維度進化方法。該方法可同時針對多個腫瘤相關(guān)靶標分子篩選兼具高親和力、高特異性和高度穩(wěn)定組裝性能的靶向多肽,在腫瘤診療中顯示出極大的優(yōu)勢。此外,該方法由于在腫瘤組織原位環(huán)境下進行分子定向進化,所獲得的分子在復(fù)雜的活體環(huán)境中更具穩(wěn)定性。
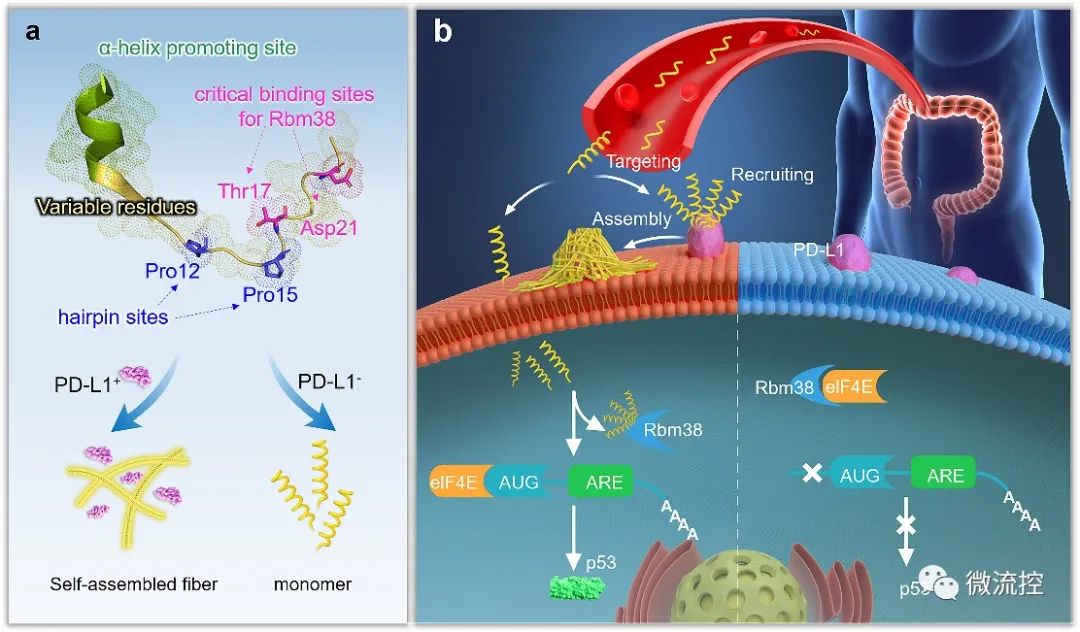
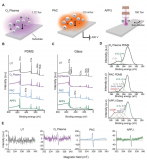
首先,通過分析靶標蛋白PD-L1與Rbm38的晶體結(jié)構(gòu),從頭設(shè)計并構(gòu)筑了容量為10?的多肽庫,并在肽庫中引入具有聚集誘導(dǎo)發(fā)光(AIE)性能的TPE分子來指示多肽的穩(wěn)定組裝性能。然后利用微陣列芯片上的三維進化策略在結(jié)合能力、自組裝性能以及特異性三個維度進行了肽庫篩選,優(yōu)化出了一條具有高內(nèi)涵性能的靶向多肽TAP。
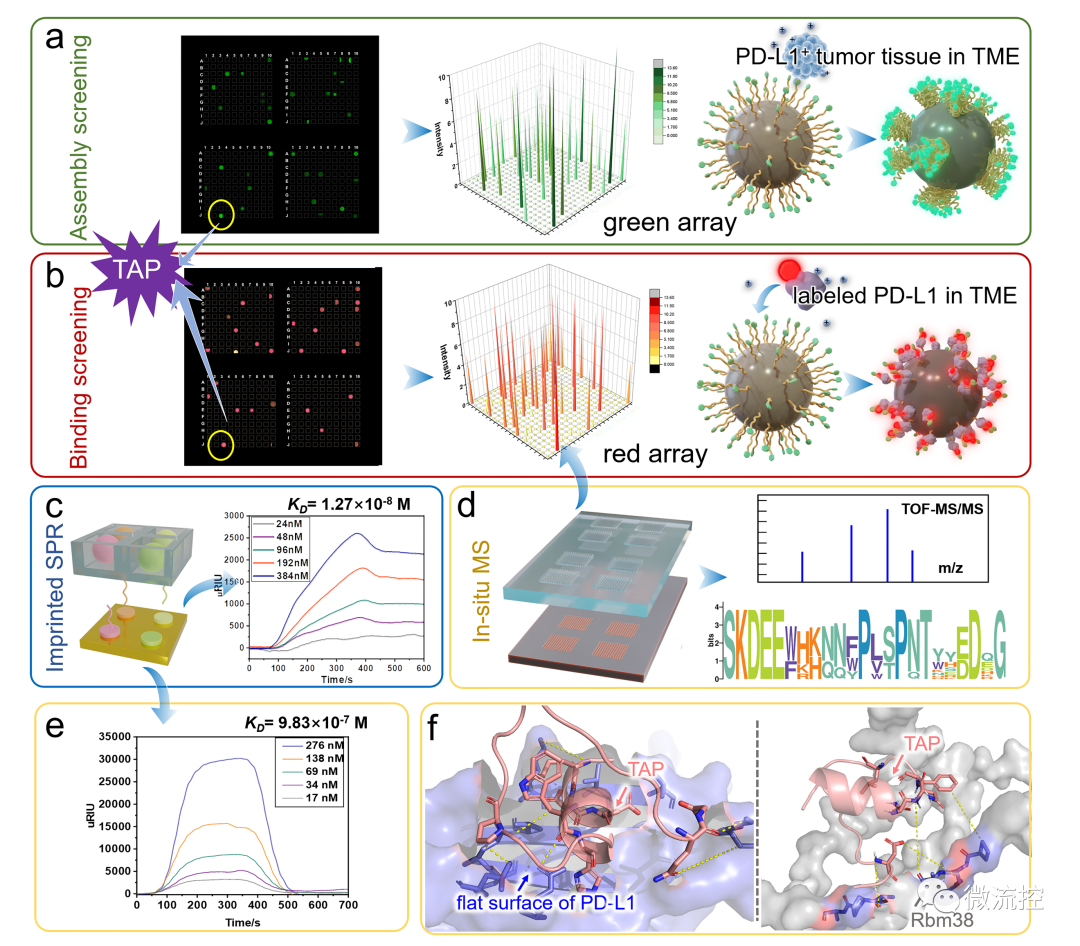
TAP的演化與表征
進一步地,對TAP的生物學(xué)性能進行了研究,在分子及細胞水平上證明了TAP不僅能阻斷Rbm38-eIF4E復(fù)合物的形成上調(diào)p53表達,也能阻斷PD-1/PD-L1相互作用。值得注意的是,TAP具有全面下調(diào)細胞內(nèi)外PD-L1含量的能力,這進一步增加了其活體診療效果。同時,由于TAP的組裝性能使其在PD-L1的招募下快速形成穩(wěn)定的納米纖維進一步促進了其對相關(guān)通路的穩(wěn)定持續(xù)調(diào)控。總而言之,TAP在細胞膜上自組裝阻斷PD-L1,同時下調(diào)整個細胞中PD-L1的表達,這與其激活p53的能力相結(jié)合,使TAP成為一種潛在的強大的抗腫瘤先導(dǎo)分子。
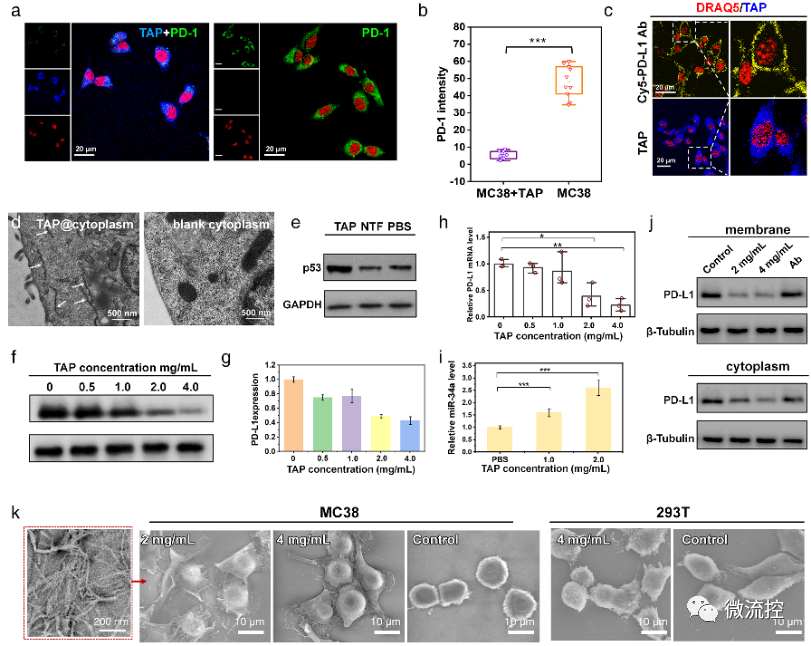
TAP在細胞水平的腫瘤抑制作用
進一步地,通過使用AFM、TEM、CD、XRD及分子動力學(xué)模擬等手段對TAP自組裝行為進行了研究。證明了其可在腫瘤微環(huán)境中能夠轉(zhuǎn)變成α-helix結(jié)構(gòu),并通過對PD-L1的特異性識別和招募下以極低的濃度進行快速組裝。
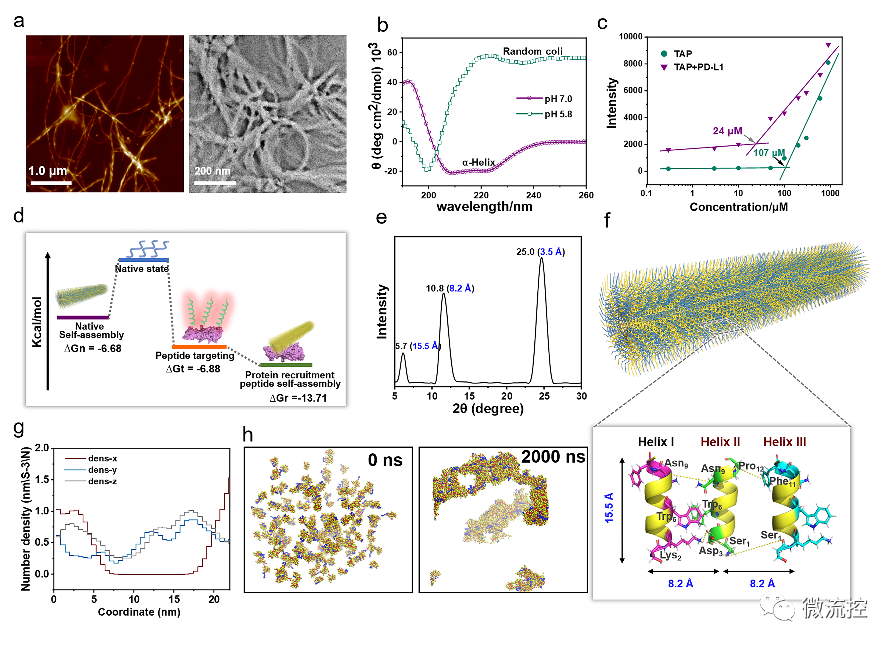
TAP自組裝行為的表征
在正常小鼠及免疫抑制小鼠水平上,證實了TAP能特異性的靶向腫瘤組織,并展示出優(yōu)于抗體的抗腫瘤效果。
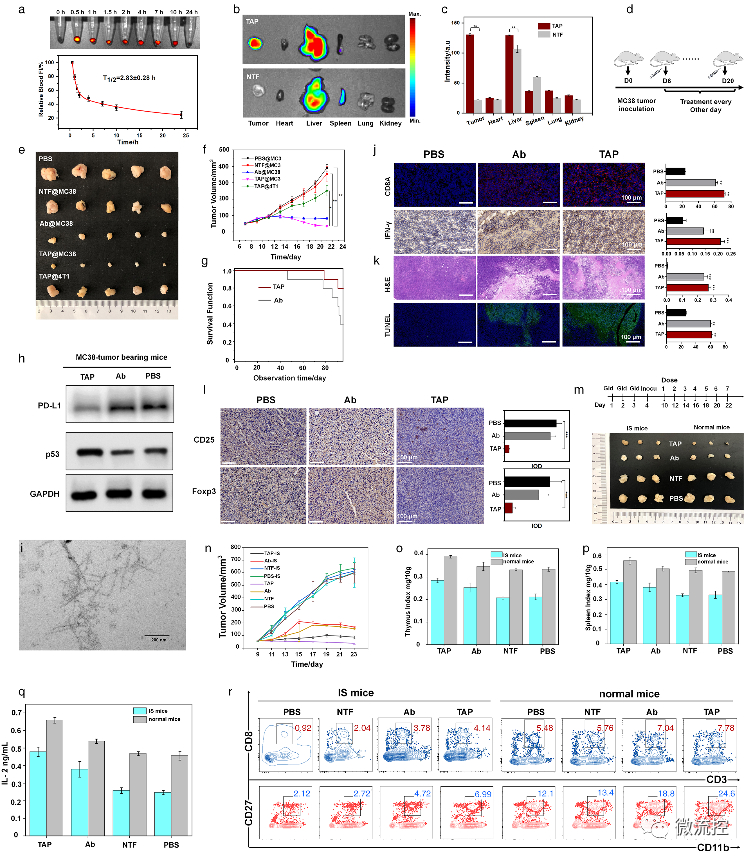
TAP的體內(nèi)腫瘤抑制作用
為了進一步了解TAP抑癌分子機制,采用了基于RNA測序(RNA-seq)的轉(zhuǎn)錄組和基于質(zhì)譜的蛋白質(zhì)組方法繪制了遺傳和蛋白質(zhì)組圖譜。
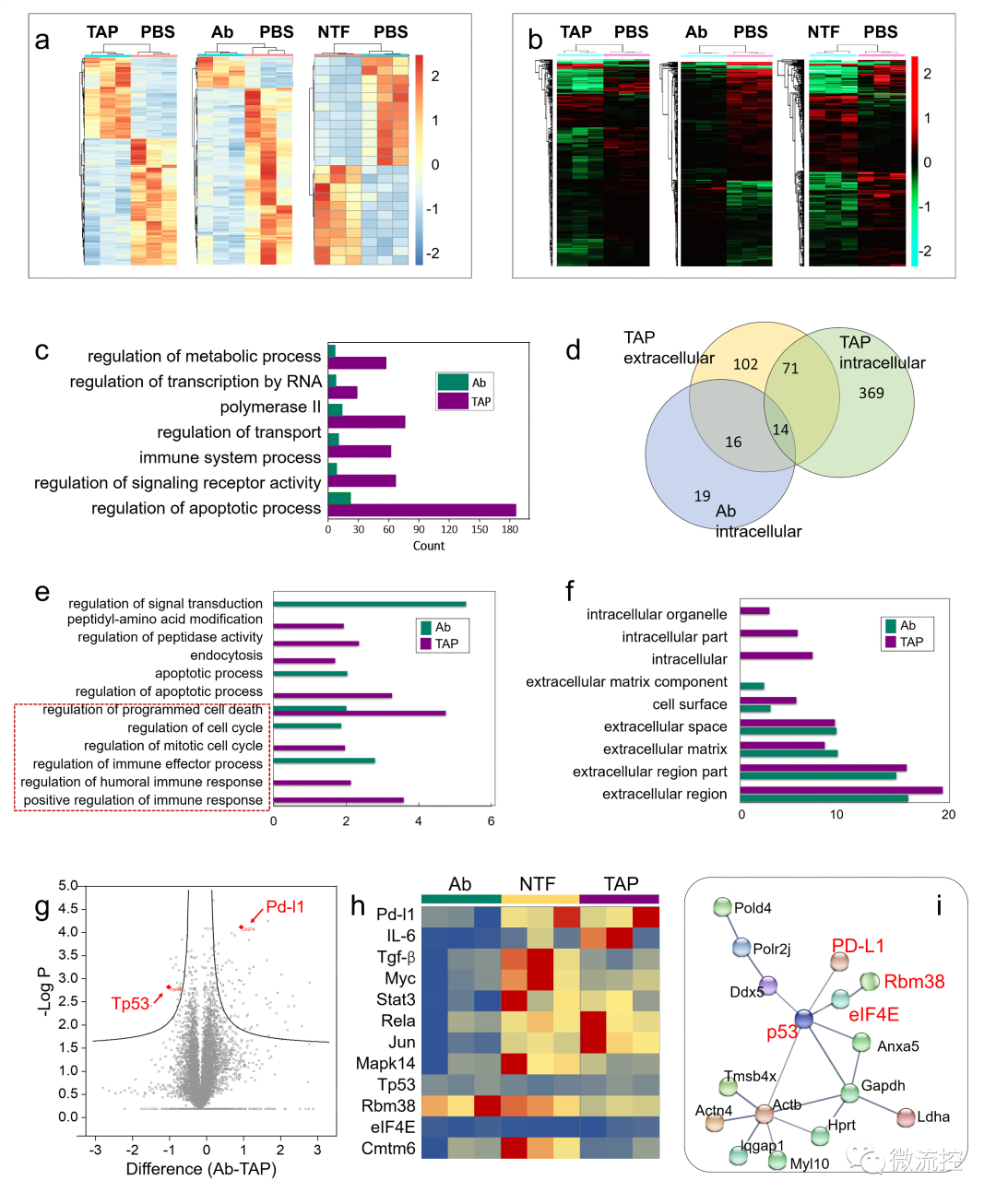
TAP治療后腫瘤的轉(zhuǎn)錄組和蛋白質(zhì)組結(jié)果
最后,在患者來源腫瘤異種移植(PDX)模型中,對TAP的抗腫瘤效果進行了驗證。
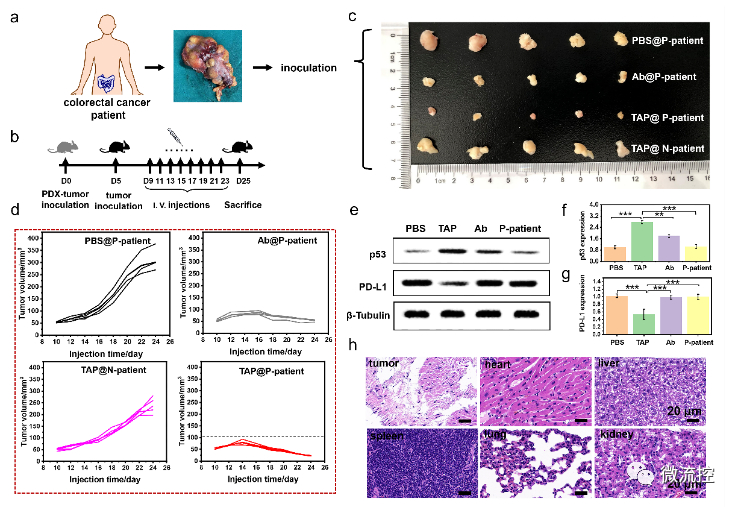
TAP對PDX小鼠的體內(nèi)治療效果驗證
總的來說,該研究通過基于微流控芯片的靶向多肽多維度進化方法成功篩選出了具有多重性能的新型靶向多肽分子。并在分子、細胞、活體、PDX水平上對其抗腫瘤效果及機制進行了詳細的研究。該工作為高內(nèi)涵靶向多肽的篩選提供了新方法,也為基于分子識別的癌癥精準診療提供了新思路。
上述成果以“Totipotent ‘All-in-one’ Peptide Sequentially Blocks Immune Checkpoint and Reverses Immunosuppressive Tumor Microenvironment”為題發(fā)表在國際頂級期刊Advanced Materials上。北京理工大學(xué)為第一通訊單位,化學(xué)與化工學(xué)院博士研究生張黎民為論文第一作者,北京理工大學(xué)王蔚芝研究員為最后通訊作者。新加坡國立大學(xué)陳小元教授,國家納米科學(xué)中心胡志遠研究員、趙敏芝研究員以及北京理工大學(xué)的蔣振奇博士為共同通訊作者。山西省中醫(yī)院,上海交通大學(xué)附屬瑞金醫(yī)院,上海中醫(yī)藥大學(xué)附屬龍華醫(yī)院等在患者組織樣本及醫(yī)學(xué)倫理評估等方面給予了大力支持。
論文鏈接: https://doi.org/10.1002/adma.202207330
審核編輯 :李倩
-
芯片
+關(guān)注
關(guān)注
459文章
51757瀏覽量
431329 -
微流控
+關(guān)注
關(guān)注
16文章
569瀏覽量
19329
原文標題:基于微流控芯片的靶向多肽分子多維度進化方法
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
紙基微流控芯片的加工方法和優(yōu)勢
微流控芯片鍵合技術(shù)
常用的微流控芯片類型
安泰功率放大器應(yīng)用領(lǐng)域:微流控技術(shù)和分子結(jié)合的體外診斷研究

















評論