非小細胞肺癌(NSCLC)腦轉(zhuǎn)移患者具有存活率低和發(fā)病率高的特點。雖然腫瘤腦轉(zhuǎn)移(BM)的診斷技術和治療策略不斷進步,但由于大腦本身具有不同于其他器官的獨特特征,使得BM-NSCLC細胞與腦腫瘤微環(huán)境(BTME)之間的微妙聯(lián)系仍有待研究。星形膠質(zhì)細胞和腦特異性內(nèi)皮細胞(BECS)是BTME的兩個主要組成部分,BM-NSCLC與兩種類型的BTME細胞相互作用,會影響B(tài)M-NSCLC的惡性轉(zhuǎn)移,以及耐藥性的增加。
鑒于此,為更好的了解BM-NSCLC與BTME之間微妙的關系,韓國國家癌癥中心的Lee團隊基于星形膠質(zhì)細胞、BECS和患者來源的BM-NSCLC細胞構(gòu)建了一種3D微流控裝置,該裝置為闡明潛在抗癌藥物的分子靶點和針對轉(zhuǎn)移的癌細胞與BTME之間的相互影響提供了一種工具。相關研究成果以“Recapitulated Crosstalk between Cerebral Metastatic Lung Cancer Cells and Brain Perivascular Tumor Microenvironment in a Microfluidic Co-Culture Chip”為題發(fā)表在Advanced Science期刊上。

為了模擬BM-NSCLC與BTME之間的微妙的作用關系,研究人員選用患者來源的腫瘤細胞(BM-ADC,BM-Sqcc)、星形膠質(zhì)細胞和BECS設計了一種微流控裝置,以達到共培養(yǎng)三種細胞的目的。該裝置具有四個單元,每個單元具有四個培養(yǎng)基通道(通道#1和#3)和三個水凝膠通道(通道#2和#4)。其中BM-ADC或BM-SqCC引入通道#4,星形膠質(zhì)細胞引入通道#2,BECS培養(yǎng)在通道#1中。在單獨培養(yǎng)BM-NSCLC細胞(BTME-)或與星形膠質(zhì)細胞和BECS(BTME+)共培養(yǎng)的條件下,保持BM-NSCLC細胞的干性,并通過CD44與CD133證實。共培養(yǎng)7天后,發(fā)現(xiàn)BM-NSCLC細胞活力增強。
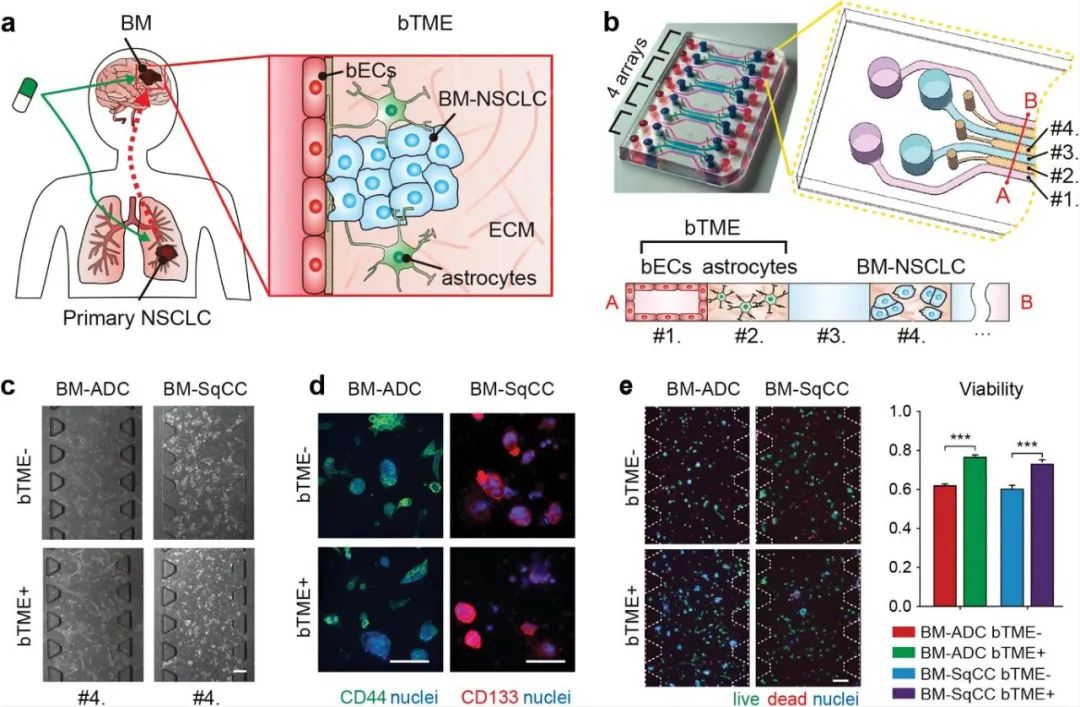
圖1 非小細胞肺癌細胞的腦轉(zhuǎn)移生態(tài)位示意圖及微流控裝置
研究人員為更好分析三種細胞之間的相互影響,開發(fā)了一種獨特的細胞和培養(yǎng)基收集方法,可以選擇性地收集各種細胞與培養(yǎng)基。首先收集通道#3的培養(yǎng)基進行細胞因子分析,然后收集通道#1的BECS細胞,接著再分別收集通道#4中的BM-NSCLC細胞和通道#2中的星形膠質(zhì)細胞。為了只獲取通道#4中的BM-NSCLC細胞,首先將膠原酶注射到通道#3中,并控制膠原酶的流動方向,使其僅能將通道#4中水凝膠分解,最后收集通道#2中的星形膠質(zhì)細胞,該方法的成功率約為80%。
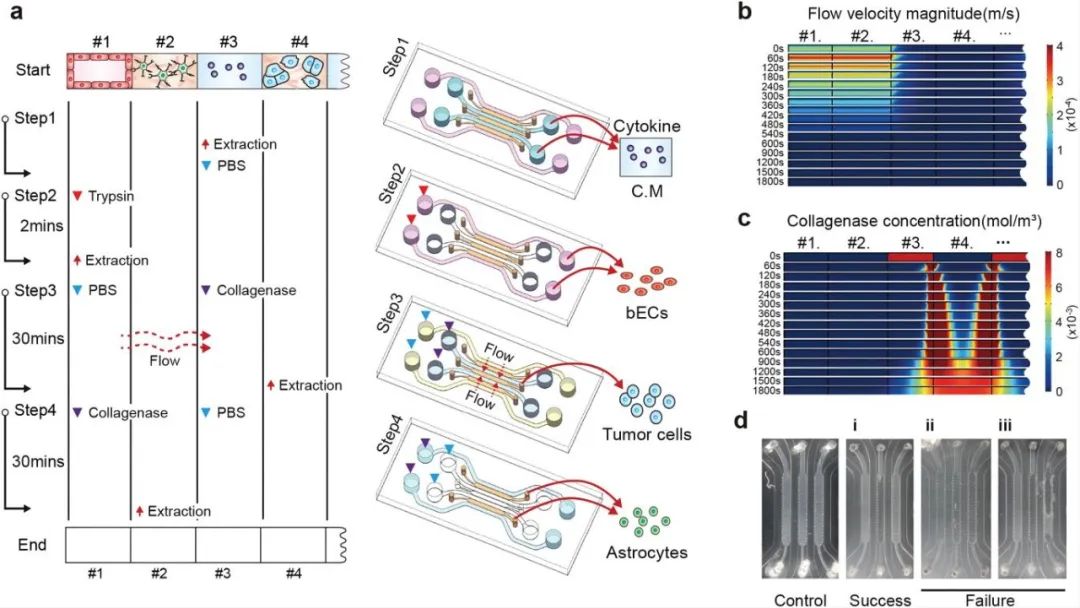
圖2 微流控裝置中分離提取培養(yǎng)基和細胞的步驟
通過對培養(yǎng)基中三種與患者組的生存率降低有關的細胞因子分析發(fā)現(xiàn),在BTME+狀態(tài)下,三種細胞因子,即絲蛋白E1(Serpin E1)、白介素8(IL-8)和分泌型磷蛋白1(SPP-1)均增加,Luminex分析證實了這一點。且由于BM-NSCLC細胞的消耗,所有BTME-病例的SPP-1濃度均低于正常對照(神經(jīng)基礎培養(yǎng)液培養(yǎng))。對Serpin E1的分子擴散進行模擬,發(fā)現(xiàn)其從BTME擴散到了BM-NSCLC細胞(通道#4),并且BTME細胞分泌的IL-8也在12h內(nèi)擴散到了BM-NSCLC細胞(通道#4)。與Transwell模型對比發(fā)現(xiàn),微流控裝置中細胞因子的濃度是Transwell模型中的10倍。
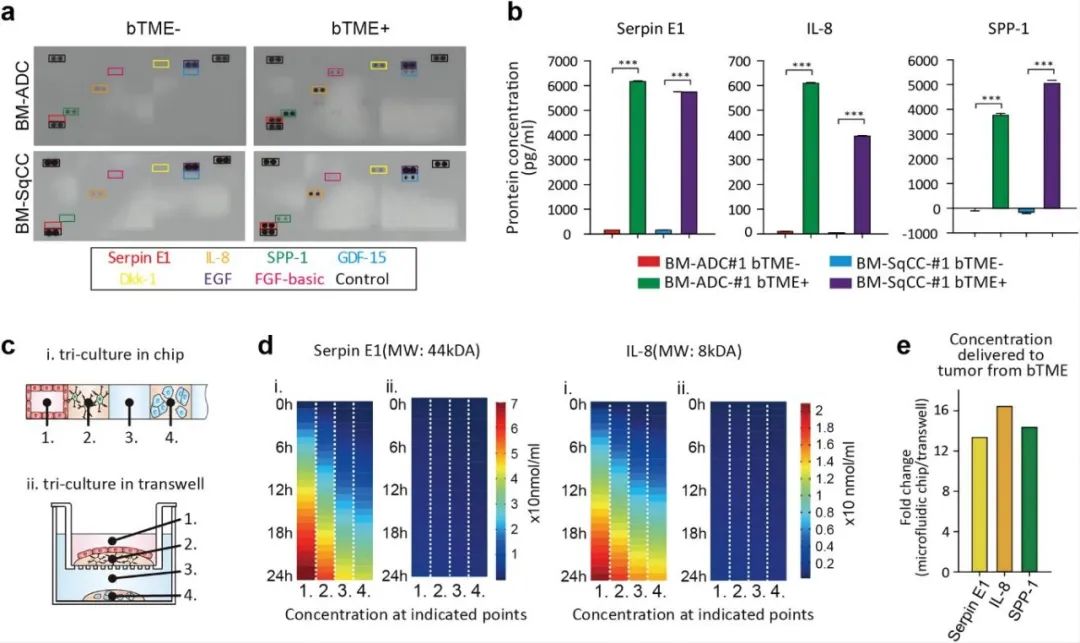
圖3 微流控裝置中細胞因子水平
研究人員分別對有無BTME的BM-NSCLC細胞、有無BM-NSCLC細胞的BECS細胞和有無BM-NSCLC細胞的星形膠質(zhì)細胞進行基因分析。發(fā)現(xiàn)BTME+BM-NSNLC細胞上調(diào)與免疫反應相關的基本分子、激活腫瘤壞死因子信號通路(TNF)和NF-kB轉(zhuǎn)錄因子活性等,進一步證實了之前的研究結(jié)論,即BTME促進BM。
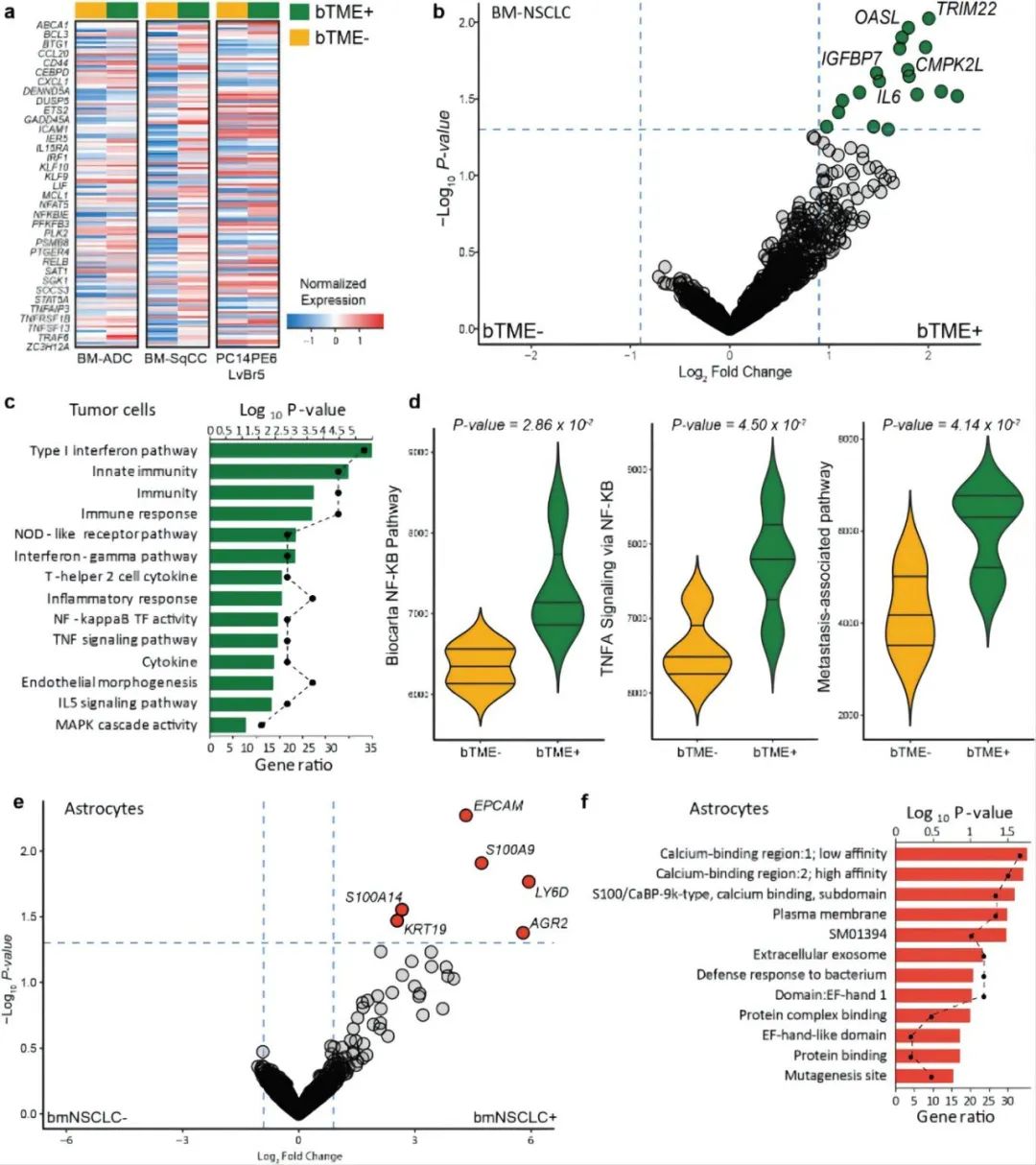
圖4 TME中腫瘤細胞轉(zhuǎn)錄圖譜
研究人員接下來測試了FDA批準的6種臨床藥物(包括Afatinib、PKI587、Palbociclib、Ceritinib、Dasatinib和Trametinib)治療BTME-和BTME+BM-NSCLC細胞的效果。根據(jù)Cancer SCAN基于5095個臨床樣本預測了6種藥物的使用效果。將預測結(jié)果與微流控裝置和Transwell中有無BTME的BM-NSCLC細胞的藥物篩選結(jié)果進行了比較,發(fā)現(xiàn)BTME-BM-ADC細胞對Afatinib和PKI587敏感,對Ceritinib、Dasatinib和Trametinib耐藥,與預測相反的是對Palbociclib耐藥,并且BTME+BM-ADC細胞對Afatinib和PKI587也耐藥。根據(jù)Cancer SCAN預測結(jié)果顯示BM-SqCC的遺傳性狀可能是野生的,且對于BM-SqCC細胞,BTME對細胞存活率有明顯的增強作用。然而在Transwell中,培養(yǎng)的BM-NSCLC細胞在篩查結(jié)果和預測結(jié)果之間也顯示出良好的相關性,在Transwell中與BTME共培養(yǎng)時沒有觀察到顯著的藥物反應變化。
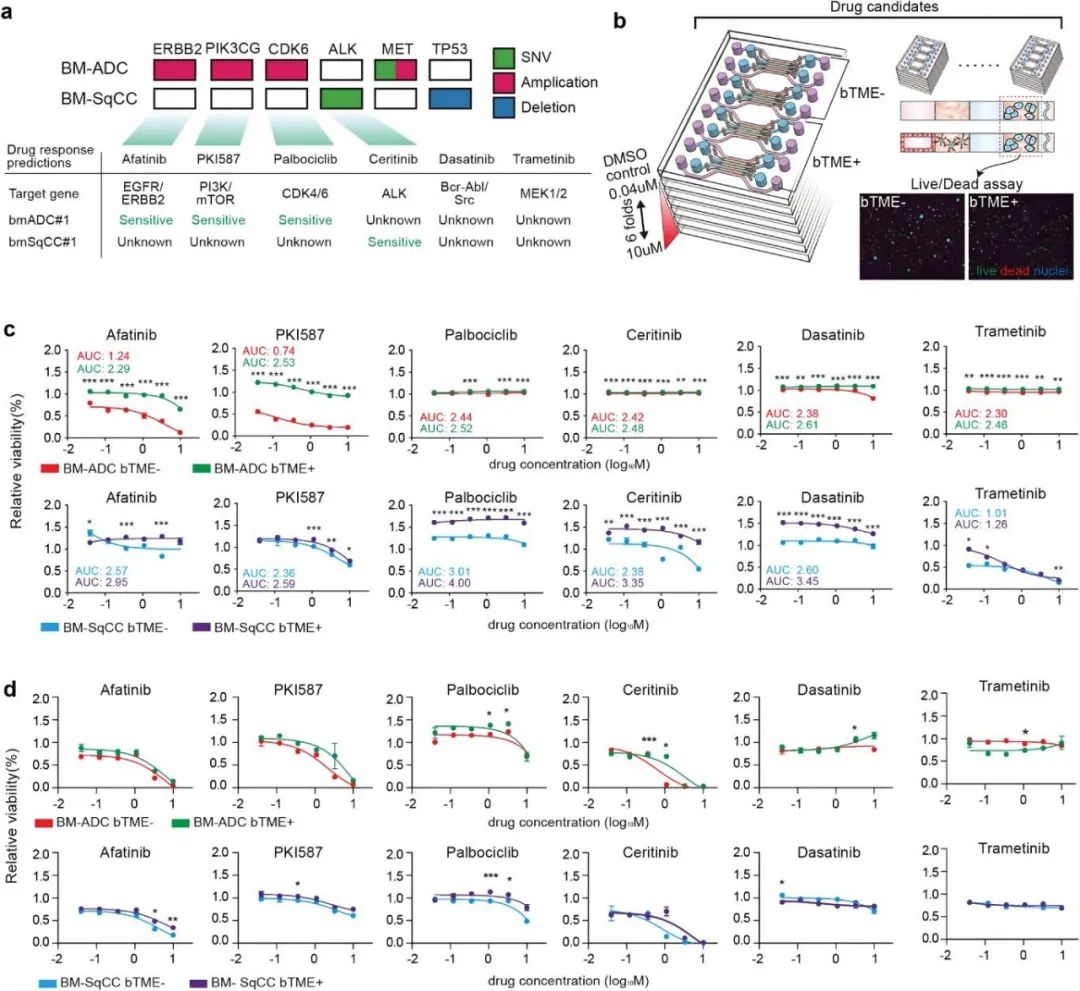
圖5 基于微流控裝置進行藥物篩選
總之,研究人員基于患者來源的腫瘤細胞、星形膠質(zhì)細胞和BECS構(gòu)建了一種能夠模擬BM-NSCLC復雜BTME的3D微流控裝置,并開發(fā)一種可以單獨收集各種細胞和培養(yǎng)基的方法,以便進行更深入的分子研究。該模型為精準治療和臨床前評估針對轉(zhuǎn)移和耐藥腫瘤的全新治療方案提供了一種潛在的藥物篩選模型。
論文鏈接:
https://doi.org/10.1002/advs.202201785
審核編輯 :李倩
-
微流控
+關注
關注
16文章
539瀏覽量
18942
原文標題:3D微流控芯片實現(xiàn)多種細胞共培養(yǎng),助力腦轉(zhuǎn)移性肺癌研究
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關推薦
高分子微納米功能復合材料3D打印加工介紹

騰訊混元3D AI創(chuàng)作引擎正式上線
Techwiz LCD 3D案例:LCOS模擬
FPC與3D打印技術的結(jié)合 FPC在汽車電子中的應用前景
3D打印技術應用的未來
ATA-7020高壓放大器在微流控3D細胞微球培養(yǎng)中的應用
領麥微紅外測溫傳感器在小型光敏3D打印機中的創(chuàng)新應用

3D建模的重要內(nèi)容和應用
plc是一種什么的電子裝置
什么是光場裸眼3D?

包含具有多種類型信息的3D模型
介紹一種用于絕對定量的微腔式數(shù)字PCR微流控芯片




 一種能夠模擬BM-NSCLC復雜BTME的3D微流控裝置
一種能夠模擬BM-NSCLC復雜BTME的3D微流控裝置











評論