什么是參比電極
參比電極是測(cè)量各種電極電勢(shì)時(shí)作為參照比較的電極。將被測(cè)定的電極與精確已知電極電勢(shì)數(shù)值的參比電極構(gòu)成電池,測(cè)定電池電動(dòng)勢(shì)數(shù)值,就可計(jì)算出被測(cè)定電極的電極電勢(shì)。在參比電極上進(jìn)行的電極反應(yīng)必須是單一的可逆反應(yīng),電極電勢(shì)穩(wěn)定和重現(xiàn)性好。通常多用微溶鹽電極作為參比電極,氫電極只是一個(gè)理想的但不易于實(shí)現(xiàn)的參比電極。
測(cè)量電極電勢(shì)時(shí)作參照比較的電極。嚴(yán)格地講,標(biāo)準(zhǔn)氫電極只是理想的電極,實(shí)際上并不能實(shí)現(xiàn)。因此在實(shí)際進(jìn)行電極電勢(shì)測(cè)量時(shí)總是采用電極電勢(shì)已精確知曉而且又十分穩(wěn)定的電極作為相比較的電極。測(cè)量由這類電極與被測(cè)電極組成電池的電動(dòng)勢(shì),可以計(jì)算被測(cè)電極的電極電勢(shì)。
在參比電極上進(jìn)行的電極反應(yīng)必須是單一的可逆反應(yīng),其交換電流密度較大,制作方便,重現(xiàn)性好,電極電勢(shì)穩(wěn)定。一般都采用難熔鹽電極作為參比電極。參比電極應(yīng)不容易發(fā)生極化;如果一旦電流過(guò)大,產(chǎn)生極化,則斷電后其電極電勢(shì)應(yīng)能很快恢復(fù)原值;在溫度變化時(shí),其電極電勢(shì)滯后變化應(yīng)較小。
參比電極的基本要求
(1)電極的可逆性比較好,不易極化。這就要求參比電極為可逆電極而且交換電流密度大(》10-5A/cm2)。當(dāng)電極流過(guò)的電流小于10-7A/cm2時(shí),電極不極化。即使短時(shí)間流過(guò)稍大的電流,在斷電后電位能很快回復(fù)到原來(lái)的數(shù)值。
(2)電極電位比較穩(wěn)定,且較靠近零電位,不易極化或鈍化。參比電極制各后,靜置數(shù)天以后其電位應(yīng)穩(wěn)定不變。
(3)電位重現(xiàn)性好。不同人或各次制作的同種參比電極,其電位應(yīng)相同。每次制作的各參比電極,在穩(wěn)定后其電位也應(yīng)相同,其差值應(yīng)小于lmV。
(4)溫度系數(shù)小,即電位隨溫度變化小。而且當(dāng)溫度回復(fù)到原先的溫度后,電位應(yīng)迅速回到原電位值。
(5)制備、實(shí)際使用和維護(hù)比較方便,經(jīng)久耐用。能滿足上述要求的參比電極有氫電極、甘汞電極、硫酸亞汞電極、氧化汞電極、氯化銀電極等。這些電極多數(shù)為第二類電極。
參比電極的作用是什么
參比電極的穩(wěn)定性使其在作為電參考點(diǎn)或用于測(cè)量位于土壤或水中的其他金屬電位方面非常有用的。當(dāng)參比電極通過(guò)電壓表處于土壤或水中的其他金屬連接時(shí),參比電極便成為半腐蝕電池。用于測(cè)量埋地或水下管道電位的參比電極所具有的電位值通常比鋼鐵的電位更正。
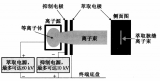
參比電極是測(cè)量電解質(zhì)中金屬電位的一個(gè)重要裝置,是陰極保護(hù)系統(tǒng)重要的組成部分,既可以為了檢測(cè)各種不同金屬的電極電位,起一個(gè)基礎(chǔ)參照的作用,又可以作為恒電位儀自動(dòng)控制的信號(hào)源。
在陰極保護(hù)工程中普遍使用的參比電極是Cu/飽和CuSO4參比電極、高純鋅參比電極、銀/氯化銀參比電極,因?yàn)檫@些電極的電位有非常好的重復(fù)性,同時(shí)電極可以多次使用,構(gòu)造簡(jiǎn)單,經(jīng)濟(jì)實(shí)惠。
參比電極是陰極保護(hù)系統(tǒng)中不可缺少的一個(gè)重要部分,因此參比電極的質(zhì)量好壞直接影響到整個(gè)陰極保護(hù)系統(tǒng)的整個(gè)施工和檢測(cè)的數(shù)據(jù)是否準(zhǔn)確。
參比電極的使用范圍
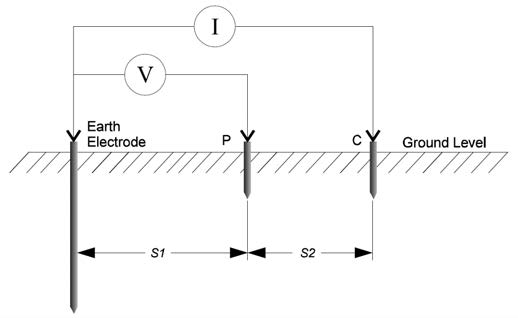
用具有適當(dāng)輸入阻抗的直流電壓表、測(cè)試線和一支穩(wěn)定的參比電極,例如飽和銅/硫酸銅參比電極(CSE)、銀/氯化銀電極(Ag/AgCl)或飽和氯化鉀(KCl)甘汞電極,就可以進(jìn)行管道對(duì)電解質(zhì)電位測(cè)量。當(dāng)電解質(zhì)是土壤或淡水時(shí),一般用CSE測(cè)量,但它不適用于海水中。當(dāng)在高氯環(huán)境下使用CSE時(shí),在確認(rèn)讀數(shù)的有效性之前,必須對(duì)CSE的穩(wěn)定性進(jìn)行檢查。銀/氯化銀電極通常用于海水環(huán)境中,飽和氯化鉀甘汞電極更多的用于實(shí)驗(yàn)室中。然而,多面聚合物膠質(zhì)飽和KCl甘汞電極也可使用,但需要適當(dāng)增加對(duì)環(huán)境的接觸面積。
參比電極使用方法
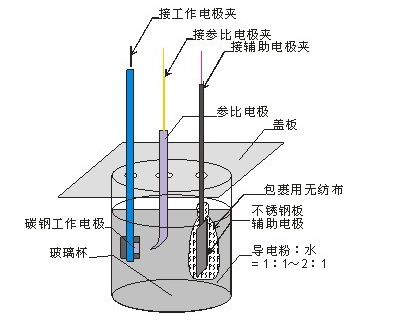
1、使用前,首先擰開(kāi)后蓋,添加蒸餾水,使參比電極溶液處于飽和狀態(tài),溶液中有硫酸銅晶體沉淀即為飽和,然后在清潔的水中浸泡20分鐘左右。
2、把參比電極豎直放入被測(cè)物體附近的土壤中,如果土壤干燥的話,適當(dāng)加些水,以確保參比電極與土壤接觸良好。
3、把參比電極的測(cè)量線接在萬(wàn)用表的黑色接線端;
4、被測(cè)量物體(陰極線)接萬(wàn)用表的紅色接線端;
5、萬(wàn)用表的放置于直流電壓檔位,檔位量程為2V。
6、該檔位顯示的數(shù)值即為所要測(cè)量的電位。
7、當(dāng)參比電極內(nèi)部的電極棒表面變黑時(shí),用細(xì)砂布打磨電極棒至銅本來(lái)的顏色。
8、為確保銅電極和硫酸銅溶液的接觸面積足夠大,溶液不夠時(shí),要加入蒸餾水;并且在蒸餾水后,溶液中保持有過(guò)剩的硫酸銅晶體。
9、長(zhǎng)期不使用時(shí),參比電極底部朝上,以免硫酸銅析出。
10、正常使用中不要用力過(guò)大,一面損壞參比電極。
常用參比電極
氫電極
用鍍有鉑黑的鉑片為電極材料,在氫氣氛中浸沒(méi)或部分浸沒(méi)于用氫飽和的電解液中,即可組成氫電極。其電極電勢(shì)EH2與溫度T、溶液的pH值和氫氣的壓力pH2(大氣壓)有關(guān)。有時(shí)采用與研究體系相同的溶液作為氫電極的溶液,以消除液體接界電勢(shì)。氫電極容易失效,應(yīng)當(dāng)避免在溶液中出現(xiàn)易被還原或易發(fā)生吸附中毒的物質(zhì),如氧化劑、易還原的金屬離子、砷化物和硫化物等。
甘汞電極
由汞、甘汞和含Cl-的溶液等組成,常用Hg|Hg2Cl2|Cl-表示。電極內(nèi),汞上有一層汞和甘汞的均勻糊狀混合物。用鉑絲與汞相接觸作為導(dǎo)線。電解液一般采用氯化鉀溶液。用飽和氯化鉀溶液的甘汞電極稱為飽和甘汞電極,這是最常用的參比電極;而用1N氯化鉀溶液的則稱為當(dāng)量甘汞電極。甘汞電極的電極電勢(shì)與氯化鉀濃度和所處溫度有關(guān)。它在較高溫度時(shí)性能較差。
銀/氯化銀電極
由覆蓋著氯化銀層的金屬銀浸在氯化鉀或鹽酸溶液中組成。常用Ag|AgCl|Cl-表示。一般采用銀絲或鍍銀鉑絲在鹽酸溶液中陽(yáng)極氧化法制備。銀|氯化銀電極的電極電勢(shì)與溶液中Cl-濃度和所處溫度有關(guān)。
汞/氧化汞電極
這是堿性溶液體系常用的參比電極,表示式為Hg|HgO|OH-。它由汞、氧化汞和堿溶液等組成,其結(jié)構(gòu)同甘汞電極。它的電極電勢(shì)取決于溫度和溶液的pH值。
 電子發(fā)燒友App
電子發(fā)燒友App











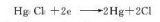











評(píng)論