以下文章來源于Uselong Biotech,作者玉珠隆生物
電導率測量技術已經經歷了一個多世紀的發展,至今它依然是分析領域中廣泛使用的一個重要參數。由于其高度的可靠性、出色的靈敏度、迅速的響應能力以及相對低廉的成本,電導率測定成為了一個既高效又易于操作的質量控制工具。電導率反映的是溶液中所有溶解離子(如鹽、酸、堿和某些有機物)的總體導電能力,這是一個非特異性的總體參數。該技術無法區分溶液中的各種不同離子。測量得到的電導率讀數與樣品內所有離子的綜合效應成正比。因此,這項技術非常適合用于監測各種類型的水質(例如純水、飲用水、天然水、工業用水等)以及其他溶劑,同時也適用于測量導電性化學品的濃度。
電導率是衡量物質導電能力的指標,它描述了物質能夠多好地傳遞電流。電流的流動依賴于物質中帶電粒子的存在。根據這些帶電粒子的特性,導體可以分為兩大類。第一類是由具有外層電子的原子晶格構成的導體。在這些材料中,電子構成了一個“電子云”,它們可以自由地脫離原子并在晶格或材料中移動,從而傳導電流。金屬、石墨以及某些其他化合物都屬于這一類。第二類導體被稱為離子導體,它們與第一類導體的主要區別在于,電流是由離子而非自由電子來傳導的。在這類導體中,電荷的轉移總是伴隨著物質的遷移。這些導體由帶電且可移動的離子組成,通常被稱為電解液。它們通過在極性溶劑(如在水中)溶解或熔化來實現電離。
電導率定義:
根據歐姆定律V=R×I可知溶液中的電壓V與電流I成正比。該公式中R為電阻(單位歐姆,Ω),V為電壓(單位伏特,V),I為電流(單位安培,A)。電阻R是比例常數,可使用測得的電壓V除以測得的電流I進行計算。
電導(用G表示,單位為西門子,S)的定義為電阻的倒數,即G=1/R
為了測定樣品的電阻或電導,需要使用測量電極的設備。該設備至少包含兩個帶有相反電荷的電極板,它們共同構成了測量電極系統。這些電極板與絕緣支撐體一起,組合形成了一個完整的傳感器單元。
讀數取決于測量電極板的幾何形狀,以電極常數(K)表示。它是電極板距離(L)和面積(A)的比值,即K=L÷A。該公式中,K為電極常數(單位cm-1),L為電極板之間的距離(單位cm),A為電極板之間電解液的有效橫截面積(單位cm2)
電導可轉化為標準化的電導率(σ),其獨立于測量電極的設置。該值通過電導乘以電極常數獲得:σ=G×K= G×L÷A。電導率σ的單位為S/cm。
溶液的電導率:純溶劑不具導電性,因此電導率接近零。只有帶有離子或極性鍵的溶解固體才可使溶液導電。絕對純水也包含一些離子,因此導電,該效果由水的自電離導致。
溶解離子:固體溶解和離子形成被稱作電解電離。這是在溶劑中導電的前提。電解電離的示例如下所示:
NaCl→ Na++ Cl-
HCl→ H++ Cl-
CH3COOH→ CH3COO-+ H+
電解液可以根據其電離程度被劃分為強電解液和弱電解液。強電解液,如氯化鈉,在水中能夠完全電離,生成鈉離子(Na?)和氯離子(Cl?)。而弱電解液,如乙酸,則只能部分電離。在這種情況下,電解液中會同時存在離子形態的醋酸根離子(CH?COO?)、質子(H?),以及未電離的乙酸分子(CH?COOH)。
電解液的電離對溫度的依賴性很強,可通過電離速率或電離常數進行定量。在電解液中,僅電離后的離子部分與電導率相關。離子對電導率的貢獻率取決于其濃度、電荷和移動性。樣品電導率σ可表示為溶解離子濃度及其電化學屬性的函數,如下:

當量電導λ是離子的特定屬性,它取決于離子類型、濃度以及溫度。常見離子的當量電導見下表:
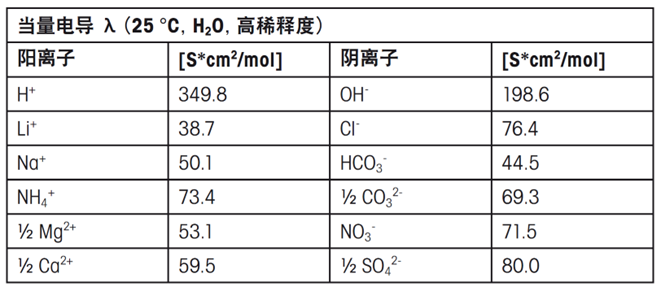
電導率會隨著離子電荷數的增加而提高,但隨著離子尺寸的增大而降低。實際測量的電導率可能與預期值有所差異,例如,鋰離子的電導率通常低于銨離子,盡管鋰離子的尺寸更小。這種現象是因為離子的溶劑化程度而非其本身的尺寸是影響電導率的關鍵因素。高電荷密度的小離子能夠吸引更多的水分子,形成比大尺寸但電荷數較少的離子更大的溶劑化殼層。
此外,質子(H+)和氫氧根離子(OH-)的電導率異常高,這并非因為它們通過離子遷移來傳輸電荷。質子的傳輸是通過水合氫離子(H3O+)與周圍水分子(H2O)之間的快速質子跳躍來實現的,而氫氧根離子的傳輸則是通過水分子與氫氧根離子(OH-)之間的質子跳躍來完成的。在這兩種情況下,電荷的傳輸主要是通過水分子間的快速質子交換,而不是通過離子的物理遷移。
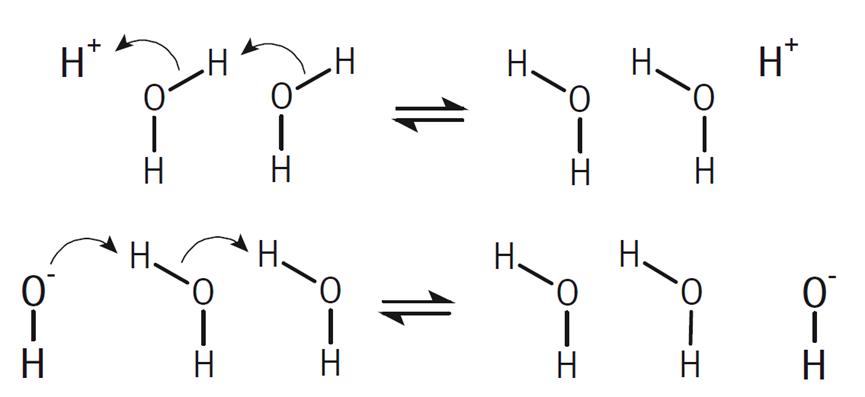
質子和氫氧化物電荷傳輸機制
正如之前所述,當量電導并非一個恒定值。它會受到多種因素的影響,其中包括濃度和溫度。首先,隨著溶液濃度的增加,當量電導會降低。這是因為在較高濃度下,相同電荷類型的離子數量增多,它們在溶液中的移動會受到更多干擾,從而降低了電導效率。對于弱電解質來說,當濃度較高時,電離程度會降低,這同樣會導致當量電導的下降。這是因為在高濃度下,電解質的電離速率減慢,釋放出的自由離子數量減少,進而影響了電導率。溫度對當量電導的影響則更為復雜。一般來說,溫度的升高會增加離子的運動速度,并減少溶劑的粘度。這種變化使得離子更容易在溶液中移動,從而提高了電導率。對于弱電解質而言,溫度的升高還能促進其電離,增加溶液中的離子濃度,進一步提升電導率。
電導率是溶液的一個重要物理特性,它受到多個參數的影響,這些參數之間存在復雜的相互作用。影響溶液電導率的關鍵因素主要有:①溶解電解液的類型:包括離子的電荷量、離子的半徑以及離子的移動性。電荷量較高的離子通常具有較高的電導率,而離子的半徑和移動性也會影響其在溶液中的遷移速度。②溶解電解液的濃度:濃度的增加通常會導致離子間的相互作用增強,從而可能降低電導率,尤其是在高濃度下。③電解質的電離度:電離度較高的電解質會釋放更多的自由離子,從而增加電導率。④溶劑的性質:包括溶劑的粘度和電容率。粘度較低的溶劑允許離子更自由地移動,而高電容率的溶劑有助于離子的遷移。⑤溫度:溫度的升高會增加離子的運動速度,減少溶劑的粘度,從而提高電導率。
水的自電離是一個重要的化學現象,它對溶液的電導率有直接影響。在純凈的水中,即使沒有外部雜質,溶液仍然可以表現出一定的電導率。這是因為水分子自身可以發生電離,生成水合氫離子(H3O+)和氫氧根離子(OH-)。純水的電導率大約為0.055 μS/cm,這一數值雖然相對較低,但在進行精確測量時仍然需要考慮。水的自電離反應是一個平衡過程,其中水分子的電離程度非常有限。在十億個水分子中,大約只有兩個分子會發生電離,生成離子。盡管自電離產生的離子數量很少,但它們對水的電導率有貢獻。因此,在評估純水或其他溶液的電導率時,需要考慮到這種自電離的影響,以確保測量結果的準確性。
電導率的測量原理:
電導率的測量是基于一個簡單的原理:通過測量溶液中電流的流動來確定其電導性,測定方法如下圖所示。
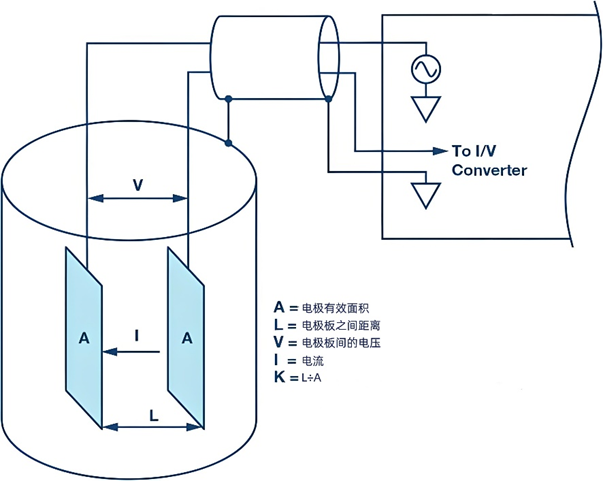
以下是測量電導率的步驟和涉及的關鍵概念:
測量裝置:使用兩個相互平行的電極(可以是平板或圓柱形),這些電極被放置在待測溶液中,并且它們之間的距離(L)是固定的。
施加電壓:為了避免電解溶液,通常在電極兩端施加一個正弦波電壓,頻率一般在1~3 kHz之間。
測量電導:通過電導儀測量兩個電極之間的電導(G),即電流通過溶液的能力。
計算電導率:為了得到電導率σ= G×K,需要兩個關鍵參數,即溶液的電導G和電極常數K。電導G可以通過測量電流和電壓得到。電極常數K可以通過公式K =L÷A計算得出,其中A是電極的有效面積,L是兩電極之間的距離。
電極常數的說明:當電極間存在均勻電場時,可以通過電極的幾何尺寸直接計算電極常數。例如,如果兩個面積各為1 cm2的方形電極相隔1 cm,那么電極常數K為1 cm?1。如果使用這對電極測得電導G為1000 μS,則溶液的電導率K為1000 μS/cm。在實際應用中,電極間可能存在非均勻電場,這時電極常數(K)必須通過使用標準溶液來確定。常用的標準溶液是KCl溶液,因為它的電導率在不同溫度和濃度下都非常穩定和準確。例如,0.1 mol/L的KCl溶液在25℃時的電導率為12.88 mS/cm。非均勻電場(也稱為雜散場或漏泄場)的特點是它沒有固定的常數,而是依賴于離子的種類和濃度。因此,一個純雜散場電極是最復雜的,因為它不能通過單次校準來滿足廣泛的測量范圍需求。
-
電阻
+關注
關注
87文章
5592瀏覽量
173864 -
測量技術
+關注
關注
1文章
197瀏覽量
25033 -
電導率
+關注
關注
1文章
247瀏覽量
14195 -
電導率儀
+關注
關注
0文章
15瀏覽量
8516
原文標題:電導率儀,你真的了解么?(放入收藏夾)
文章出處:【微信號:深圳市賽姆烯金科技有限公司,微信公眾號:深圳市賽姆烯金科技有限公司】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
關于電導率的測量原理和什么叫量程電阻
最近在做水質儀 測溫度和TDS 電導率的 卡在溫度與電導率關系,電導率測量上
電導率儀的使用方法和電導率儀工作原理
電導率儀的使用方法和電導率儀工作原理
電導率的測量原理
電導率儀的測量方法
電導率儀的概念、單位和測量原理的介紹
電導率的影響因素及測量方法
海水電導率儀的測量范圍與校準原理
什么海思電導率,電導率原理解析



















評論