隨著醫療保健技術的飛速發展,人類的預期壽命逐漸延長,老齡化人口也相應增加,這使得神經退行性疾病(ND)的發病率呈現出上升趨勢。然而,傳統的動物模型和2D細胞培養模型在模擬人類病理生理條件方面存在諸多不足,如無法準確模擬復雜的病理損傷以及忽視多發性病例等問題。
鑒于現有模型的這些局限性,我們迫切需要開發更為先進的體外模型。這些模型應能夠準確復制各種生理條件,多細胞類型和細胞間的相互作用,同時還應具備實時監測和調控的能力。通過這樣的模型,我們可以更深入地研究ND的病理過程,為疾病的預防和治療提供更為有效的策略。
最近,一些替代培養系統如3D細胞培養、3D生物打印的組織工程和微流控技術,作為傳統體外模型的替代品出現,以提供更可靠和更具代表性的人體系統。其中,微流控技術能夠復制器官的關鍵元素,并精確控制生物化學和生物力學方面,為疾病研究提供了高通量、生理相關且成本效益高的解決方案。通過結合先進的生物和工程技術,基于芯片的體外建模正在擴大其可能性,如使用2D和3D微流控芯片模擬ND。
據麥姆斯咨詢報道,近期,來自韓國成均館大學(Sungkyunkwan University)等機構的研究人員討論了使用微流控芯片建立ND模型的一般策略,并介紹了作為下一代先進相關模型的類器官芯片。最后,研究人員概述了這些模型在學術和工業藥物開發中的應用情況。總體而言,微流控芯片、干細胞和生物技術器件的整合有望為生物醫學研究以及ND診斷和治療方案的開發提供有價值的見解。相關論文以“Neuropathogenesis-on-chips for neurodegenerative diseases”為題發表在Nature Communications期刊上。
基于微流控芯片的ND模型構建方法
(1)選擇細胞源
人腦由眾多神經元和非神經元細胞構成,從而形成復雜的神經元網絡。腦血管細胞在疾病中扮演關鍵角色。每種腦細胞存在不同亞型,展現其復雜性。由于進入人腦的限制,需要開發具有區域特異性特征的源細胞方法,這在ND建模中尤為重要。現有的ND體內和體外動物模型提供了有價值的見解,但存在局限性。外部方法和非哺乳動物物種也被用于ND研究。人類胚胎干細胞(hESC)和誘導神經分化方法也被用于模擬ND,但存在倫理問題和其他需要改進的方面。家族性和散發性患者來源的誘導多能干細胞(iPSC)是另一個候選細胞來源,能產生與人類相關的病理表型。盡管動物模型發揮著重要作用,但人類患者來源的細胞更可能成為ND研究的可靠體外模型。
(2)選擇微流控芯片設計
芯片在大腦研究中被首次應用于“Campenot室”系統,用于研究神經生長因子對軸突生長的影響。隨后,研究人員通過模擬大腦的不同層次細胞,將大腦的復雜特征轉化為簡單和小型化的系統。微流控芯片由多個用于細胞共培養的室組成,這些室通過微通道、多孔膜和相位波導連接,允許不同細胞群之間的直接或間接相互作用。這種芯片設計可以控制神經突生長方向、回路連接和大小,并創建不同類型的神經元連接。此外,芯片上的閥門和外部因素可用于控制流體流動和細胞環境,從而模擬不同濃度的化學物質梯度,對疾病建模有重要作用。多孔膜基芯片作為隔室之間的接口,可以實現間接和直接的相互作用,用于模擬血腦屏障等結構。這些設計提供了更多維度的交互,有助于深入研究大腦的復雜特征。
(3)監控和分析步驟
微流控芯片在監測和分析方面具有多個優點,如實時監測、多組學分析和整合生物傳感器等。大多數微流控芯片由透明光學材料制造而成,通過流體通道入口引入非常少量的染色染料和抗體可檢測生物標志物,但需防污染和氣泡。集成生物傳感器可連續測量細胞特性,評估細胞響應。芯片腦可測量血腦屏障完整性和神經元電信號。芯片外分析工具可用于分析樣品。開放芯片設計提供了更多優勢,如暴露于化學成分、簡化收集和分析,但需注意流體流動的可控性。
(4)ND發病機制建模的應用
為了研究神經相關疾病,可通過匹配的芯片設計復制相關解剖和生理單元。然而,現有的微流控芯片研究受限于細胞來源和2D靜態設計,缺乏生理學相關性。2D系統無法模擬復雜的相互作用和生理條件,影響細胞的功能和體內相關性。相比之下,3D細胞外基質(ECM)凝膠提供了更真實的細胞環境,改善了細胞形態、遷移和信號傳導,允許時間依賴性分化和神經退行性變化。為了創造3D微環境,需要考慮ECM的特性,這些特性影響腦細胞行為和疾病機制。水凝膠已集成到微流控芯片中,以模擬更生理相關的腦組織環境。
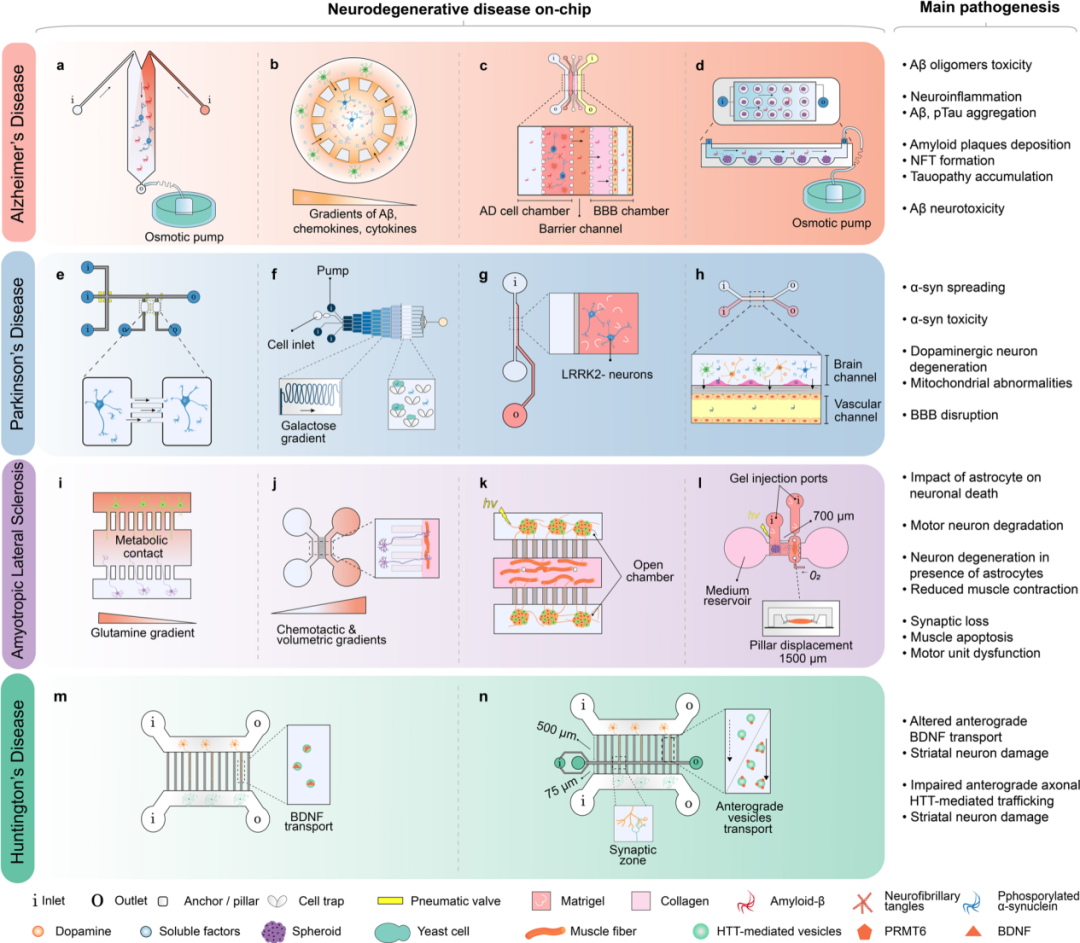
ND芯片應用案例
(1)阿爾茨海默病(AD)芯片
微流控芯片已廣泛應用于AD發病機制的研究,包括Aβ和tau病變、線粒體功能障礙和神經炎癥等,提供了傳統培養方法無法獲得的新見解。芯片可以實時可視化蛋白質病變,并發現tau蛋白的傳播特性。同時,微流控芯片可以模擬體內動態條件,如間質流速和Aβ聚集體梯度形成,以研究Aβ對神經元的毒性作用。此外,芯片還用于研究家族性AD特異性突變基因轉導的人類神經祖細胞,以及星形膠質細胞和致病蛋白在神經炎癥中的作用。通過整合不同類型的細胞,芯片可以揭示神經炎癥的分子機制。近年來,研究還關注腦特征如血腦屏障和神經血管單位在AD發病機制中的作用。微流控芯片與3D培養的結合,以及淋巴流動模擬,為探索體內類似條件提供了更多可能性。這些研究有望為AD的藥物篩選和治療策略提供新的線索。
(2)帕金森病(PD)芯片
現有的PD芯片研究多集中在α-syn相關發病機制上,而涉及多巴胺能神經元的研究較少。研究者利用微流控芯片模擬PD中多巴胺能神經元凋亡和α-syn的傳播。芯片設計能清晰觀察α-syn纖維攝取及其在神經元間的運輸。研究還探討了α-syn低聚物對突變體PD患者神經元的毒性。另外,通過微閥控制流體動力學的芯片,成功演示了α-syn的攝取和擴散。多室芯片能模擬神經元間α-syn的傳播,并成功再現復雜神經網絡。微流控芯片還應用于研究多巴胺能神經元在PD中的受損情況,血腦屏障在PD發病中的作用,以及星形細胞活性與血腦屏障功能障礙和炎癥的關系。
(3)肌萎縮側索硬化癥(ALS)芯片
基于新發現的遺傳因素,研究者開發了嚙齒動物模型來研究ALS,這些模型主要反映家族性ALS,并在體外揭示了與ALS相關的細胞過程功能障礙。盡管已存在研究有毒蛋白聚集和傳播的微流控芯片模型,但尚未有針對散發性ALS的特定模型。神經炎癥是ALS的一個致病特征,微流控培養系統可用于模擬星形膠質細胞對神經元的影響。利用微流控芯片的區隔化元素,研究者共培養了肌細胞和運動神經元以研究ALS中的NMJ損傷。這些模型重現了ALS的某些特征,但使用人類特異性運動神經元和原始嚙齒動物肌纖維時可能失去生理學相關性。其中一種定制的3D微流控芯片能夠共同培養患者來源的運動神經元球體和骨骼肌母細胞,并成功重現了ALS的某些病理過程。
(4)亨廷頓氏舞蹈癥(HD)芯片
微流控芯片在HD研究中的應用相對較少。這些芯片主要模擬皮質紋狀體網絡,該網絡在HD中易受損。研究利用轉基因小鼠神經元在芯片上探索mHTT對神經回路的毒性。芯片設計允許觀察紋狀體神經元退化和突觸減少,以及mHTT導致的運輸缺陷。研究小組還利用芯片研究藥物靶標,如APT1抑制劑ML348,可改善運動缺陷和行為改變。此外,五室芯片模擬基底神經節回路,展現不同細胞群間的連接。集成MEA的微流控芯片能實時分析神經網絡功能,檢測亨廷頓蛋白對回路的影響。電刺激微流控芯片是改進方向之一,能重現并測量皮質紋狀體回路的神經元活動,但尚未應用于HD研究。
 ?
?
用于ND建模的微流控芯片示例
基于微流控芯片的體外3D模型
腦類器官能模擬不同細胞組成的疾病特異性腦區域,如前腦、中腦和后腦。研究人員使用多種方法模擬ND,但多限于家族病例。針對ND中不同腦區域間的相互作用,Pasca等人創建了組合類器官(腦組裝體),以更好地概括區域間的相互作用,并應用于多種疾病模型。Kong等人開發的融合皮質血管集合體,可模擬系統性炎癥對AD神經炎癥的加速作用。Rickner等人則生成了神經-星形膠質細胞組裝體,展現了一些病理變化,并對治療有反應。然而,類器官模型在研究ND方面仍存在爭議,目前更適合模擬神經發育障礙,但其在細胞組成、解剖特征和腦卷積方面的成熟結果也令人鼓舞。
近年來,人們設計了多種類器官培養平臺,旨在改善類器官的體內特征、成熟度和均勻性,同時減少培養時間和勞動量。這些平臺具備與免疫和血管成分合作的能力,并可配合生物成像和生物傳感器進行有效分析。一些研究通過“一站式”微流控平臺解決了傳統類器官培養方案中的問題,實現了培養、維護和監測的全程自動化。此外,3D培養中的支架材料和微流控芯片設計也發揮了重要作用,促進了類器官的成熟和特征發展。同時,血管化和免疫相互作用的模擬對于進一步表征腦類器官至關重要。微流控芯片還可以與生物成像設備和生物傳感器集成,實現精確的監測和分析。
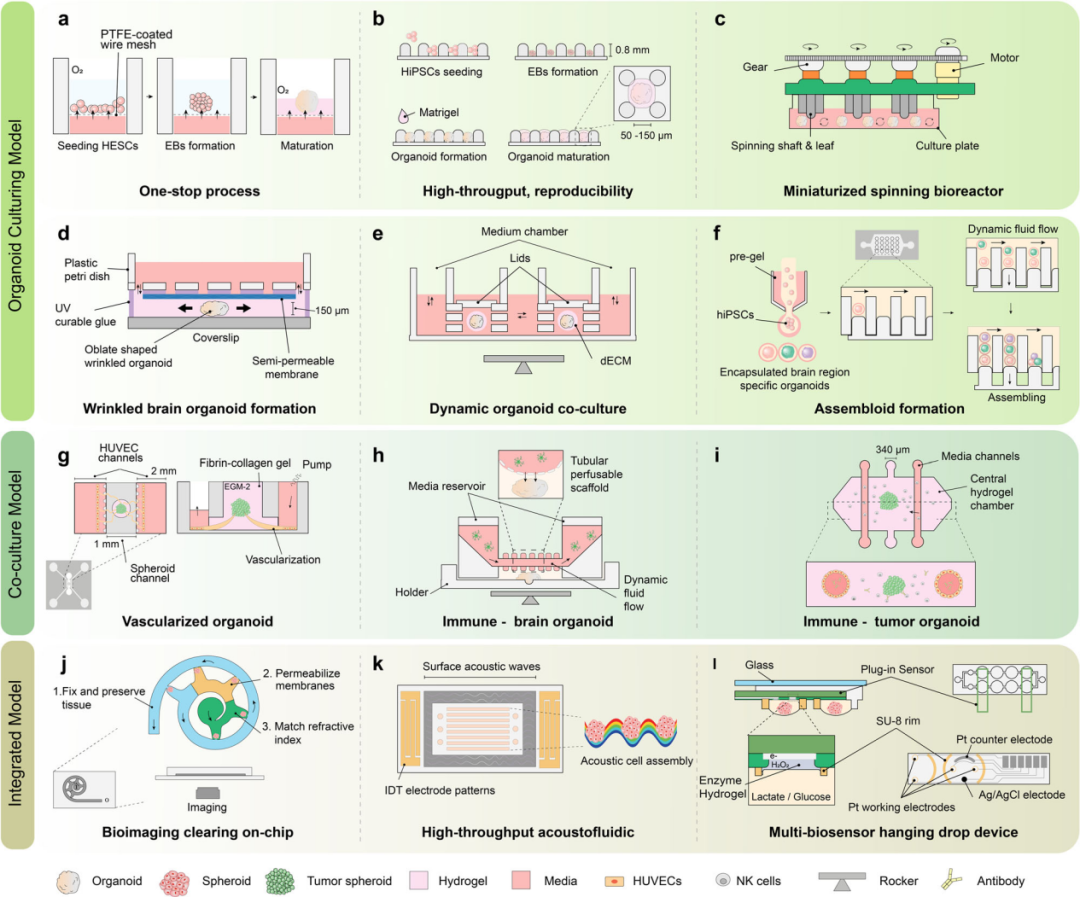
具有代表性的片上類器官設計
基于微流控芯片的體外模型在藥理學領域的應用前景
(1)ND藥物開發面臨的挑戰
盡管在疾病理解和技術創新方面取得了實質性進展,但開發非傳染性疾病的有效治療方法仍具挑戰性。最近AD治療有所突破,但新藥的有效性僅針對特定階段,且Aβ-抗抗體在人類認知中的效果存在爭議。考慮到ND的多因素和異質性,仍需更多努力擴大藥物有效性。此外,開發過程需成本效益高且省時。過去AD藥物開發投入巨大但成果有限,失敗原因包括干預時機不當、生物標志物不足和研究模型不準確。家族性基因工程小鼠模型存在局限性,不能完全復制ND特征,且長期保存昂貴耗時。因此,將研究轉向更生理相關的人類細胞體外模型,結合新藥特征,有望降低成本和時間,產生更具代表性的測試結果。
(2)微流控芯片在制藥行業中的應用
近二十年來,體外模型在學術界逐漸發展,但制藥行業尚未采納微流控芯片。隨著FDA政策轉向使用更多人類相關模型進行藥物測試,學術界和制藥行業開始使用芯片上的器官和基于器官的模型。一些大型制藥公司已使用類器官和微流控芯片提高藥物篩選準確性。全球也在努力將學術成果轉化為制藥行業,利用標準化和可重復的藥物篩選方法。美國國立衛生研究院啟動了贈款項目,驗證用于藥物測試的組織芯片平臺,包括復制腎臟、肝臟和血腦屏障的微生理系統,以提高其應用的可靠性、可重復性、穩健性和吞吐量。
(3)用于學術層面藥物篩選的微流控芯片
制藥行業在解決可重復性和可擴展性問題上持續努力,同時學術領域也在芯片上進行潛在ND藥物成分的藥物篩選和毒性研究。許多公司提供微流控芯片供研究人員用于疾病機制、藥物篩選和毒性的研究。一些研究小組已經利用這些芯片對先前被拒絕的候選藥物進行了重新評估。此外,單層培養方法常用于藥物發現,但3D細胞培養和患者來源的類器官被認為能提供更接近體內特征的模型,有望提高臨床預測性。學術界已經開始將類器官應用于藥物發現研究,這些研究不僅評估了藥物對功能性3D共培養的影響,還評估了藥物通過內皮細胞(EC)屏障的傳遞。新型類器官培養藥物篩選平臺也展現出患者源性類器官在ND藥物篩選中的潛力。
(4)先進微流控芯片在制藥行業的應用前景
全球合作努力整合微流控芯片與先進技術,有望徹底改變制藥行業。類器官芯片和多器官芯片系統在藥物發現中起關鍵作用,從靶標識別到臨床前篩選,甚至可用于臨床階段決定患者亞型的有效治療。然而,實現這一目標需克服可靠性、可重復性、兼容性等技術和工業挑戰,同時需要定義驗證和建模基準。先進的芯片系統能驗證藥物對神經病理的影響,測量功能變化,為ND提供臨床相關評估。多器官芯片平臺可測試藥物作用機制、安全性等,減少動物模型依賴,提供更具代表性、成本效益和準確的結果。患者來源的細胞源可促進有效治療發展。未來,微流控芯片將為腦類器官和組裝體翻譯及ND藥物發現和個性化醫療發展做出貢獻,盡管面臨生物、技術和商業挑戰,但微流控芯片和分子生物物理技術有望促進對ND發病機制的理解,減少對動物模型的依賴。
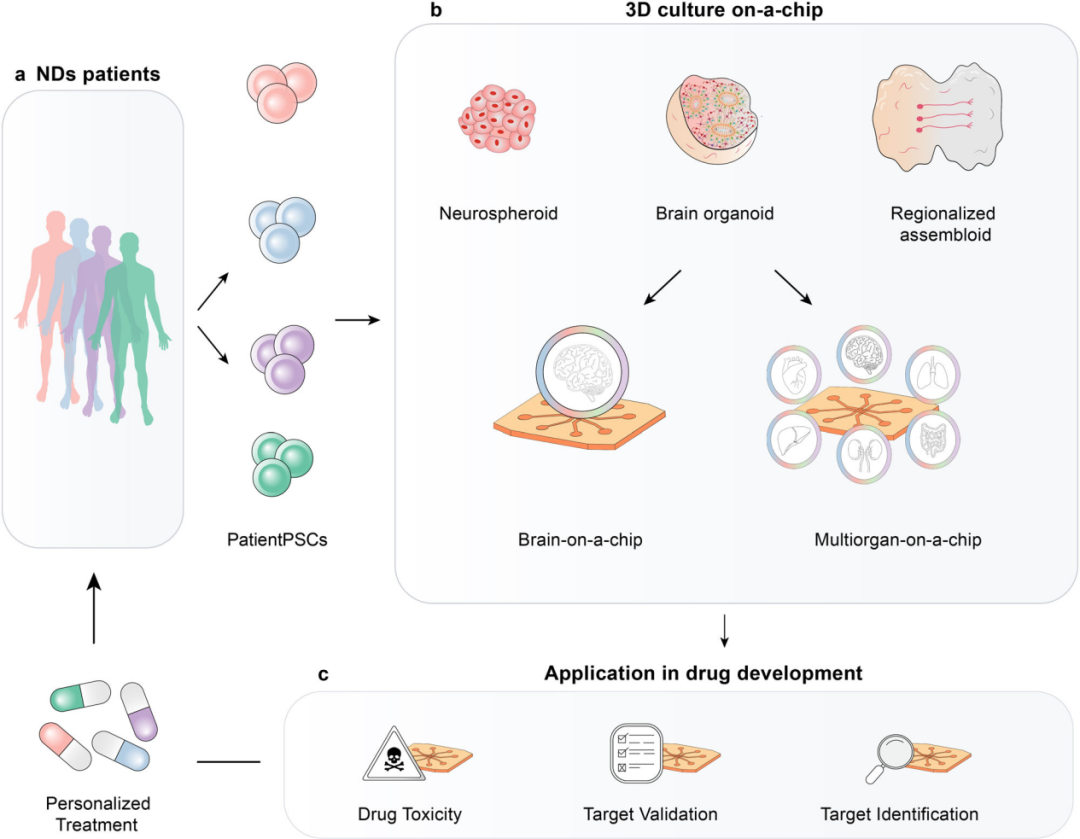
用于藥物開發的片上ND的未來展望
綜上所述,該論文探討了利用先進的體外系統來模擬不同類型的神經退行性疾病,為生物醫學研究和藥物開發提供了寶貴的見解。傳統的2D和靜態條件下的微流控芯片在模擬神經退行性疾病時存在生理學上的局限性,而采用3D細胞外基質凝膠可以提供細胞更多的機械結構和生化信號,從而改善細胞形態、遷移行為、信號傳導和基因表達等方面的相關性。此外,文中還提到了神經退行性疾病的病理生理機制,如Tau蛋白的傳播和聚集,以及細胞外基質對疾病發生發展的重要性。本綜述有助于讀者更好地了解神經退行性疾病研究領域的最新進展和未來發展方向。
論文鏈接:
https://doi.org/10.1038/s41467-024-46554-8
-
微流控芯片
+關注
關注
13文章
292瀏覽量
19090 -
生物傳感器
+關注
關注
12文章
380瀏覽量
37650 -
神經元
+關注
關注
1文章
368瀏覽量
18638
原文標題:綜述:用于構建神經退行性疾病模型的微流控類器官芯片研究進展
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
中山大學:在柔性觸覺傳感電子皮膚研究進展
安泰功率放大器應用:微流控技術積骨缺損中的應用
微流控技術在病原微生物檢測中的研究進展
常用的微流控芯片類型
芯片上集成功能性血管化類器官的微流控平臺
如何使用Python構建LSTM神經網絡模型
AI大模型的最新研究進展
PyTorch神經網絡模型構建過程
基于神經網絡算法的模型構建方法
上海大學:研發電化學生物傳感器檢測神經系統疾病生物標志物



















評論