單分子水平的蛋白質分析揭示了集合平均技術所掩蓋的異質性行為。酶的數字量化通常涉及通過熒光底物的轉換來觀察和計算分成微區的單分子。然而,這種基于線性信號放大的策略僅限于周轉率足夠高的少數酶。
近期,來自法國巴黎物理化工學院 - 巴黎文理研究大學(ESPCI Paris-PSL Research University)的研究人員提出了一種基于分子編程和液滴微流控的替代性技術,用于對各種DNA和RNA加工酶進行數字檢測。相關研究成果以“Functional analysis of single enzymes combining programmable molecular circuits with droplet-based microfluidics”為題發表在Nature Nanotechnology期刊上。
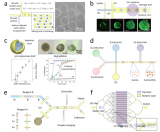
該研究利用一種被稱為可編程超靈敏分子放大器(PUMA)的通用分子電路,該電路對DNA信號進行閾值指數放大,并與各種輸入活動相耦合。PUMA包括一個轉換模塊,該模塊將目標(此處為酶活性)與短DNA信號鏈的產生聯系起來,還包括一個DNA-酶擴增系統,該系統最終會產生強烈的熒光讀數。DNA-酶擴增系統由三個DNA模板組成:利用DNA聚合酶(Vent(exo-))和切口酶(Nb.BsmI)構成自動催化模板,實現催化信號鏈的指數復制;假模板使一部分信號鏈失活,從而起到催化引流的作用,以避免由滲漏反應引起的非特異性、非靶標依賴性擴增;而前熒光報告模板(rT)與信號鏈雜交,聚合后產生熒光信號。
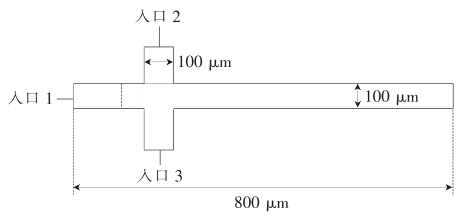
此外,研究人員設計了一個轉換模塊,將擴增開關連接到用于診斷應用的缺口酶Nt.BstNBI(簡稱NBI)活性,以便用于診斷。研究人員在NBI濃度增加的情況下實時監控反應。正如預期的那樣,目標濃度越高,信號鏈的產生越快,因此指數擴增開始得越快。該方法的整體靈敏度約為1μ/ml(每毫升毫單位,即約400 fM的活性酶),比基于熒光底物線性轉化的分析低四個數量級。
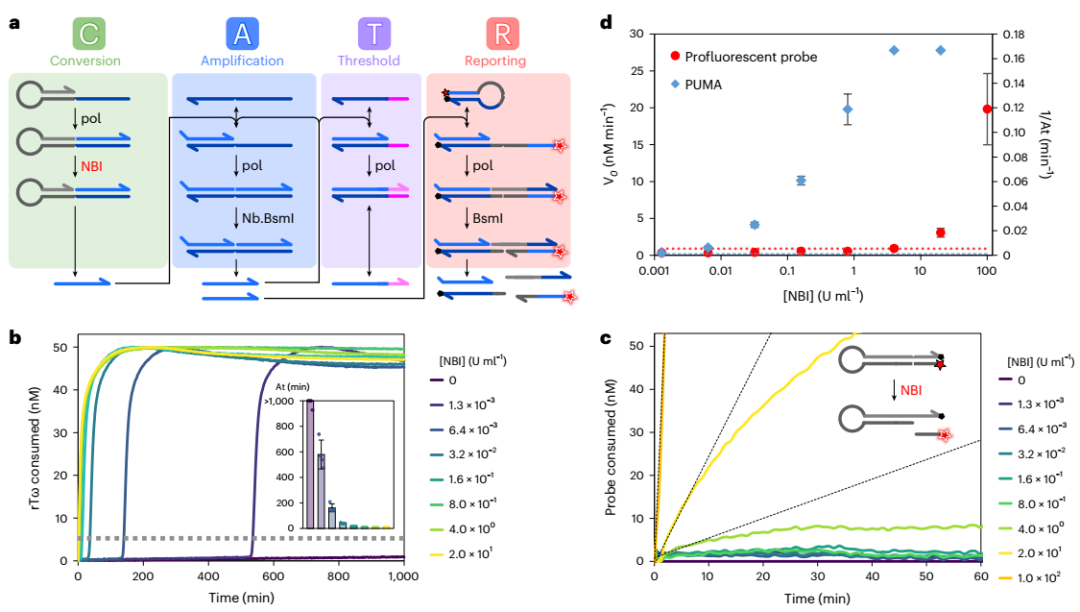
圖1 NBI缺口酶活性的檢測原理
利用基于PUMA的檢測的高靈敏度特性,研究人員設想了一種通用方法,稱為數字PUMA(dPUMA),用于單一酶的計數。為了對此進行評估,研究人員在NBI電路中加入不同濃度的目標酶,然后分成單分散的微滴,通過終點熒光顯微鏡對這些微滴進行擴增和分析。通過量化陽性液滴的比例并假設隨機、泊松分布(方法),確定了活性酶的濃度,發現在廣泛的稀釋系列中,活性酶的濃度與初始輸入濃度成比例,證實了該酶的準確數字檢測。這種dPUMA工作流程可以與所有一鍋法分析兼容,并適用于多種酶活性分子的絕對定量。引人注目的是,數字讀數顯示催化活性酶的濃度大大低于總酶濃度(由制造商提供),有時低幾個數量級。在排除了可能的實驗假象(如乳化過程中酶的失活或損失或大量污染蛋白的存在)后,研究人員得出結論,樣品確實包含大量非功能性酶,這可能源于蛋白質生產、純化和/或儲存過程中的失活。
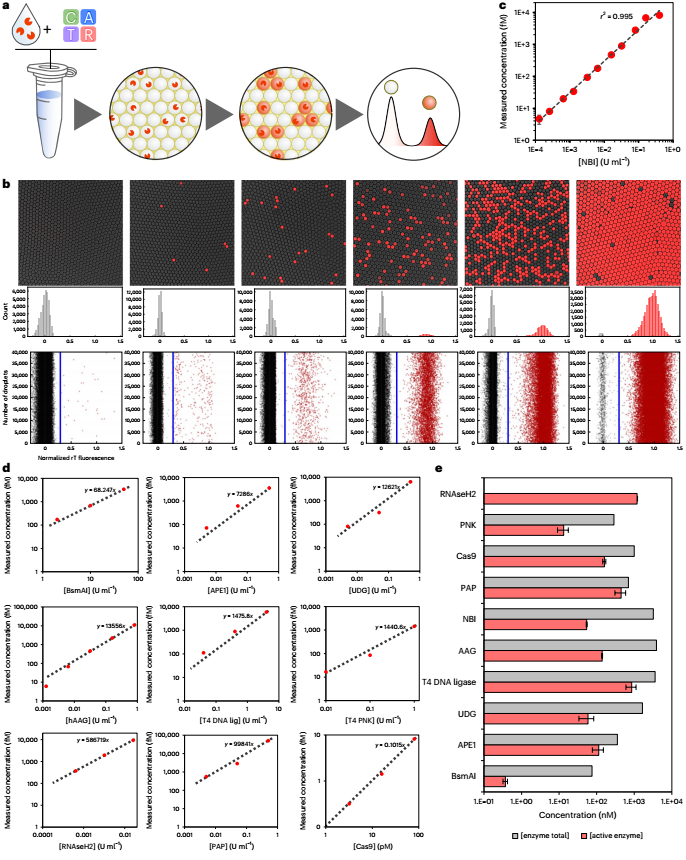
圖2 DNA相關酶的數字檢測
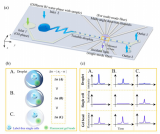
為了進一步研究酶混合物的組成和進化,研究人員使用實時版本的dPUMA方案評估了理論上相同的多肽庫(商業NBI)的活性分布。研究人員乳化了不同酶濃度的樣品,以測量不同泊松參數(λ)下的活性分布。每個被占據的液滴內的起始時間被用作酶活性的代表:酶活性越強,擴增越快,這一假設被批量測量中起始時間和酶活性之間的單調關系所證實。從圖3f可以看出,在低λ(<2)下的擴增時間較窄,這使得區分不同占有率(一種、兩種、三種或四種酶)的液滴尖峰成為可能。研究人員驗證了活性分布由高斯函數的和進行了令人滿意的擬合,這些高斯函數各自的權重受每個樣本中λ測量值的泊松頻率的約束。液滴占有率和泊松定律之間的一致性證明了通過數字分析測得的低活性分數不是由于酶的非泊松分布(這可能發生在聚集或結合到基因組DNA長片段的酶中)。重要的是,含有單一酶的液滴中的開始時間分布的變異系數僅為17%,這表明活性酶池具有相當均勻的活性分布。
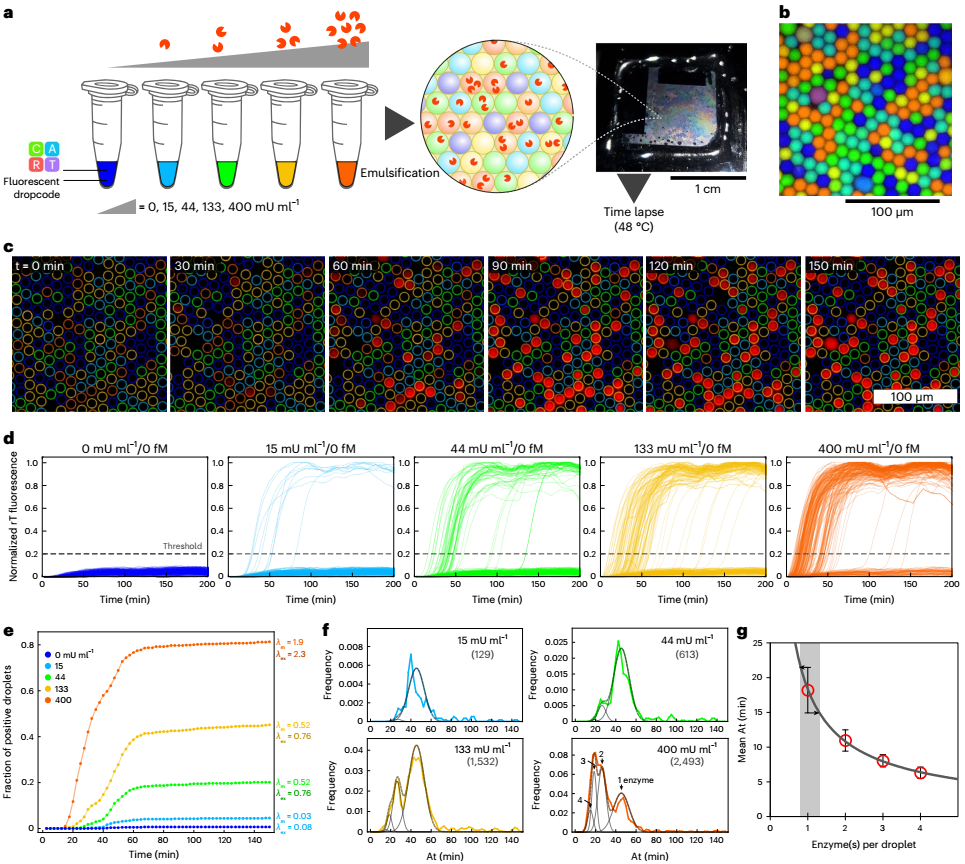
圖3 通過延時實驗評估多肽庫活性分布
為了探索無活性組分的來源,研究人員評估了在各種應激條件下活性分布是如何受到影響的:包括熱休克步驟的物理應激或化學應激。對于第一種情況,觀察到隨著熱休克持續時間的增加,酶的活性部分呈指數衰減。然而,殘留活性級分內的活性分布與未處理樣品非常相似。無論熱激溫度如何,都可以觀察到這種兩種狀態的行為,其中酶要么完全活性,要么完全失活。它與先前報告中描述的災難性變性模型的概念相一致,在該模型中,加熱的酶經歷可逆的構象變化,直到達到臨界點并不可逆地展開。
相反,在氧化處理過程中出現了一種明顯的模式:隨著H?O?濃度的增加,活性酶的比例再次下降;然而,開始時間的分布明顯偏離了未經處理的樣品:當氧化應激增強時,更多的單一酶表現出較低但可測量的活性。因此,輕度氧化應激導致一部分無活性的酶和一群具有中等活性的酶,這表明了一種機制,即活性降低的氧化底物在活性完全喪失之前是可接近的。活性位點外殘基側鏈的氧化可能會使催化袋不穩定,影響底物識別或降低支架的穩定性。在未處理的商業樣品中沒有觀察到這種拓寬的活性分布,表明它們包含的全長多肽的無活性部分可能與折疊/聚集問題有關,而不是與化學損傷有關。
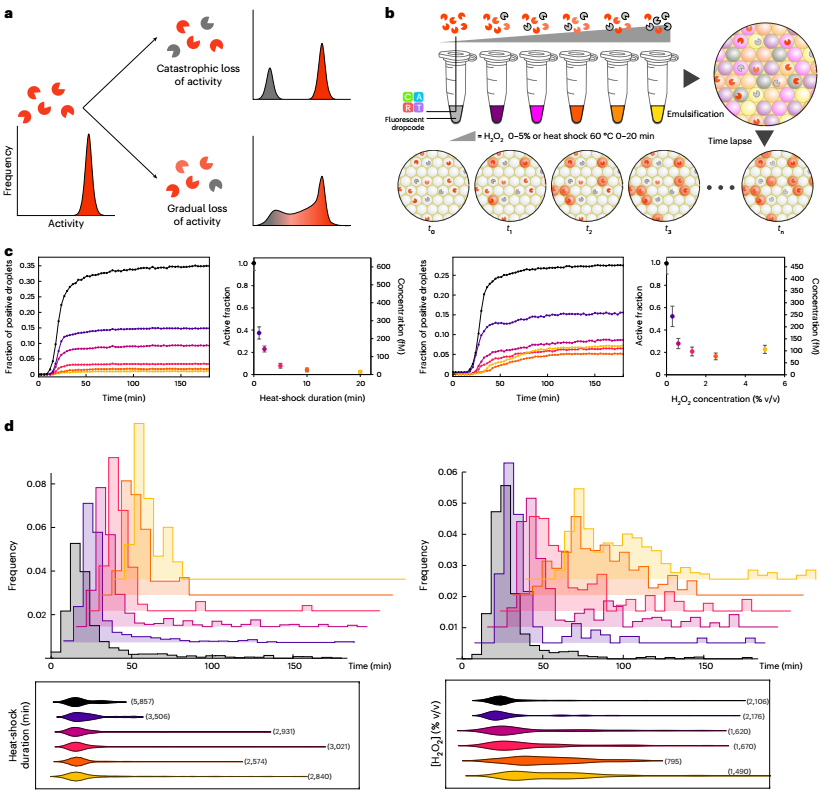
圖4 酶群體的功能異質性研究
綜上所述,研究人員通過將指數分子放大器的靈敏度與DNA酶電路和液滴讀數的模塊化相結合,可以在單分子水平上特異性地檢測幾乎所有與 D(R)NA相關的酶活性。這種被稱為數字PUMA(可編程超靈敏分子放大器)的策略已在十多種不同的酶中得到驗證,其中包括許多催化速率較慢的酶,甚至達到了化膿性鏈球菌Cas9表觀單次周轉的極限。數字計數法能獨特地獲得絕對摩爾定量,并能在所有測試的商業制劑中發現大量非活性催化劑。通過實時監測單個酶分子的放大反應,研究人員還提取了催化劑群體的活性分布,揭示了各種壓力下的其他失活途徑。該方法極大地擴展了可受益于單分子分辨率量化和功能分析的酶的數量。因此,數字PUMA 有望成為診斷或生物技術應用中精確酶定量的多功能框架。此外,這種數字測定方法還可用于研究蛋白質功能異質性的起源。
論文鏈接:
https://doi.org/10.1038/s41565-024-01617-1
-
放大器
+關注
關注
143文章
13596瀏覽量
213536
原文標題:基于分子編程和液滴微流控的單分子水平酶活性定量分析方法
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
NOVA無誤差液滴微流體
基于軌道電潤濕的液滴操控技術,有望用于新一代數字微流控平臺





 一種基于分子編程和液滴微流控的替代性技術用于數字檢測
一種基于分子編程和液滴微流控的替代性技術用于數字檢測













評論