研究背景
近年來,水系銅基電池因其出色的特性備受關注,但其應用受制于銅負極的高電位(0.34 Vvs.標準氫電極),導致現有的電化學體系常常無法提供足夠高的電壓(通常小于1 V),以滿足特定應用的需求。
研究內容
近日,深圳大學劉卓鑫助理教授、南方科技大學李洪飛助理教授和香港城市大學支春義教授合作,提出了一種配位策略來降低水銅基電池的本征負極氧化還原電位,從而提高其工作電壓。這是通過Cl?離子調整電解質來建立適當的配位環境來實現的。當與氯配位時,水系電解質中的中間體Cu+離子被成功穩定,并且電化學過程被解耦為涉及Cu2+/Cu+和Cu+/Cu0的兩個獨立的氧化還原反應;其中Cu+/Cu0的氧化還原電位比Cu2+/Cu0的低了大約0.3V。同時,與水配位相比,氯配位提高了銅利用率、氧化還原動力學和循環穩定性。
此外,利用電解液中過量的Cl?離子,構建了一種利用正極Cl?/Cl2氧化還原反應的水系銅-氯電池體系,表現出1.3 V的高放電電壓平臺,并且在10000次循環后仍保留了77.4%的初始容量。這項工作可能為提高水系銅電池的電壓開辟一條途徑。其成果以題為“Manipulating coordination environment for a high-voltage aqueous copper-chlorine battery”在國際知名期刊Nature Communications上發表,本文第一作者為深圳大學博士后張祥勇。
研究要點
氯離子的配位作用穩定了水系電解液中Cu+離子,使Cu2+離子的電化學過程被解耦為兩個獨立的氧化還原反應。
對氯配位下銅的反應機理進行深入分析,得出兩個氧化還原反應分別對應于Cu2+/Cu+和Cu+/Cu0,其中Cu+/Cu0的氧化還原電位比Cu2+/Cu0的低了大約0.3V。
采用Cl?/Cl2作為正極反應構建了Cu-Cl2電池,表現出1.3 V的高放電平臺,出色的倍率性能和良好的循環穩定性,在10000次循環后仍保留了77.4%的初始容量。
圖文導讀
圖1.鹵素離子對銅離子電化學行為的影響
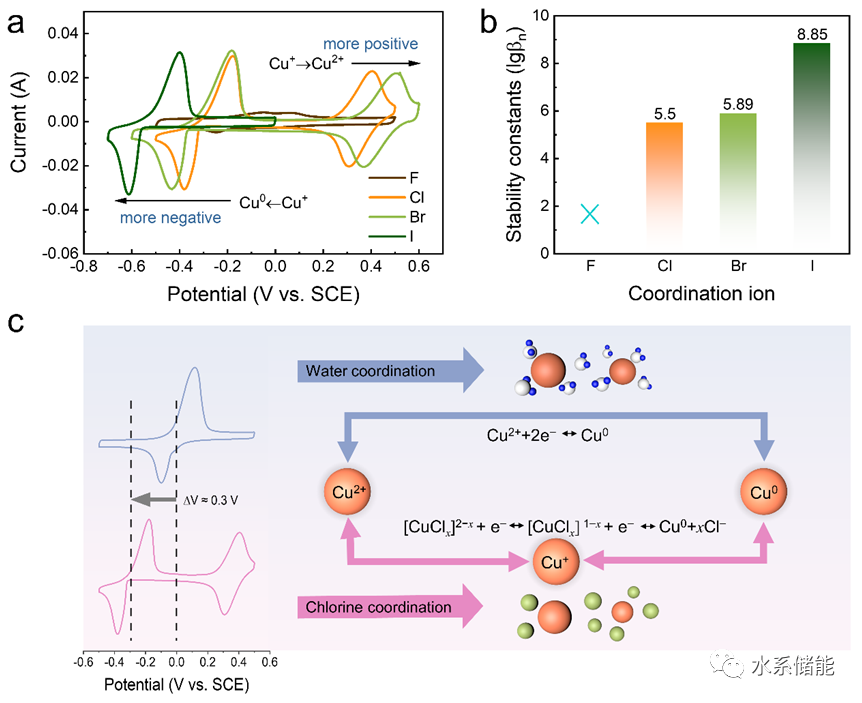
(a)在各種鹵素電解質中以10 mV s?1掃描的CV曲線。(b) 不同鹵素配合物的穩定常數。(c) 氯和水配位下氧化還原行為差異的圖示。
▲使用不同含鹵素的電解液改變銅離子的配位環境并進行循環伏安法(CV)測試。結果表明,在鹵離子(Cl?和Br?)的配位下,CV曲線中包含兩對氧化還原峰,對應Cu2+/Cu+和Cu+/Cu0的反應,表明鹵素配位使Cu+離子更加穩定。更重要的是,穩定的Cu+顯示出明顯較低的還原電位,這意味著可以構建工作電壓更高的水性銅電池。鹵化物配位環境下的氧化或還原電位變化與所形成的配合物的穩定常數相關,穩定常數越高,氧化或還原反應越難發生,從而導致更高的氧化電位和更低的還原電位。
圖2.配位環境的分析
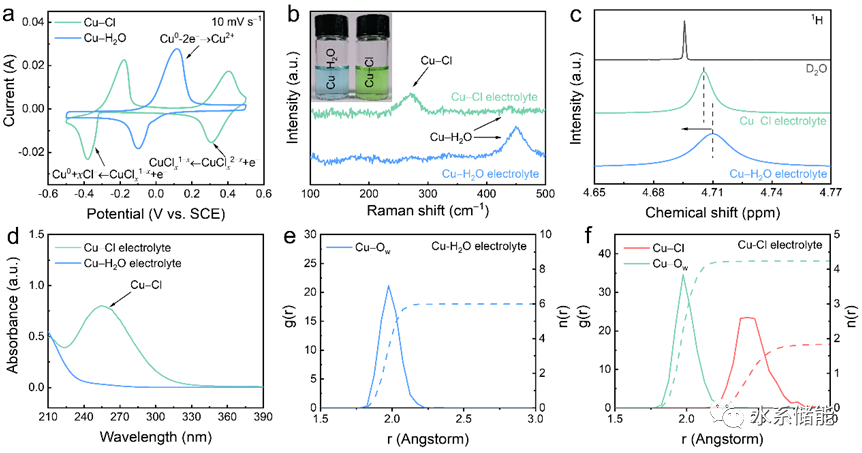
(a)以10mV s?1的掃描速率獲得的CV曲線,(b)SERS光譜,(c)1H NMR光譜,(d)Cu-Cl和Cu-H2O電解質的UV-Vis光譜。(e) Cu-H2O電解質的RDF(徑向分布函數)。(f) Cu-Cl電解質的RDF。
▲表面增強拉曼散射光譜(SERS)和核磁共振(NMR)光譜揭示了Cu?Cl電解液中銅離子與氯離子的配位作用,而紫外-可見(UV-Vis)光譜進一步證實了Cu?Cl配位復合物的形成。分子動力學模擬結果也顯示,在Cu?Cl電解液中,銅離子與氯離子發生配位,形成了氯配位的銅離子(CuCl1.8(H2O)4.2)而不是純水配位的銅離子(Cu(H2O)6)。這些發現為理解配位環境對銅離子電化學行為的影響提供了深入見解。
圖3.氯配位下,銅的氧化還原機制
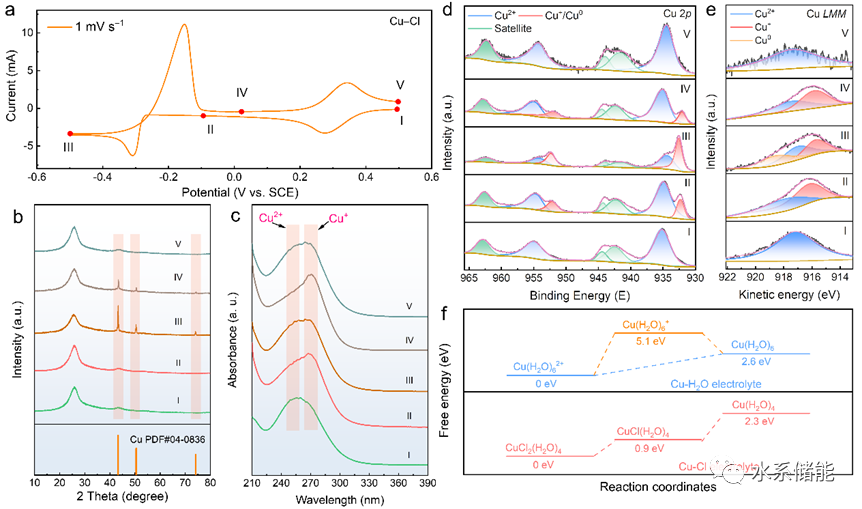
(a)以1 mVs?1的掃描速率獲得的CV曲線。(b) 相應的非原位XRD圖案。(c) 相應的非原位紫外-可見光譜。(d) 相應的非原位XPS光譜。(e) 相應的非原位XAES光譜。(f) 可能的反應途徑。
▲通過非原位分析包括X射線衍射、UV-Vis光譜、X射線光電子能譜(XPS)和X射線激發俄歇電子譜(XAES)對銅離子的氧化還原機制進行深入解析。結果表明,在氯配位下銅離子發生可逆的氧化還原反應,具體包括Cu2+/Cu+和Cu+/Cu0之間的轉化。此外,理論模擬結果與實驗數據相符,進一步支持了所提出的反應機制。根據所獲得的結果,氯配位環境下銅離子的電化學過程如下(其中x=1-4,代表配位數):
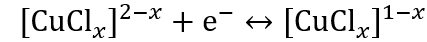 ? ? ? ? ? ?(1)
? ? ? ? ? ?(1)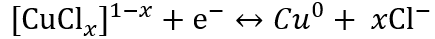 ? ? ? ? ??(2) ?
? ? ? ? ??(2) ?
圖4.銅負極的電化學性能
Cu負極在(a)Cu-Cl和(b)Cu-H2O電解液中不同掃描速率下的CV曲線。(c) 對應于a和b中三個氧化峰的b值。(d) 不同掃描速率下的電容貢獻。(e) 不同電流密度下Cu-Cl電解液中的GCD曲線。(f) Cu-H2O電解質在不同電流密度下的GCD曲線。(g) Cu-Cl和Cu-H2O電解質中的倍率性能。(h) 20 mA cm?2下Cu-Cl和Cu-H2O電解質中的長期穩定性。
▲全面對比水配位下銅的電化學性能,可知氯配位下銅負極具有如下優勢:(i) 較低的負電極電位,降低了0.3 V左右,(ii) 更高的銅離子利用率(高面容量),(iii) 更快的電化學動力學(高倍率性能),和(iv) 更好的循環穩定性。
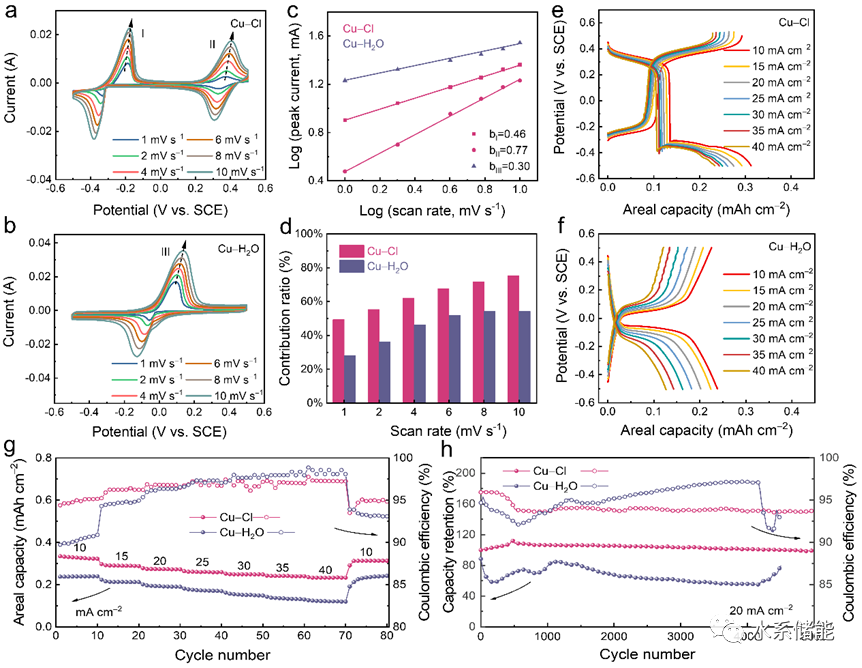
圖5.氯正極的電化學性能
(a)當使用Cu-Cl和Cu-H2O電解質時在10 mV s?1的掃描速率下獲得的CV曲線。(b) Cl2正極在10 A g?1下的GCD曲線。(c) Cl2正極在Cu-Cl和Cu-H2O電解質中在10 A g?1下的長期穩定性。(d) 4 M NaCl和0.5 M HCl和 (e)4 MNaCl的溶液中在不同電位下獲得的UV-Vis光譜。(f)CV曲線. (g) GCD曲線。(h) Cl2正極在包含4 M NaCl和0.5 M HCl的溶液中的倍率性能。
▲在Cu-Cl電解質中,正極CV曲線出現明顯的還原峰,顯示出Cl?/Cl2的正極反應可行性。通過將0.5 M HCl加入Cu-Cl電解液以提高電極的穩定性,實現了88%的容量保持率。進一步的UV-Vis光譜表明,HCl的加入抑制了氯氣與水的反應,提高了循環穩定性。正極Cl?/Cl2反應的CV曲線顯示了穩定的氧化還原行為,具有160mAh g?1的比容量和出色的倍率性能。此外,負極銅電極的氧化還原行為受HCl的影響很小。這些結果為構建Cu-Cl2電池系統提供了關鍵信息。
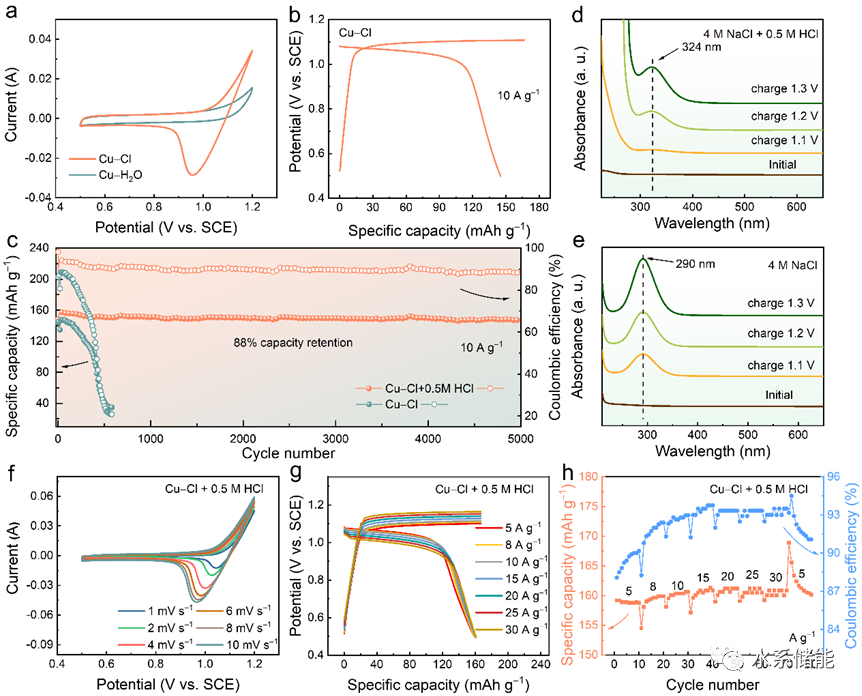
圖6.Cu-Cl2全電池的構建及其電化學性能
(a) Cu-Cl2全電池的示意圖。(b) 在不同掃描速率下獲得的CV曲線。(c) Cu-Cl2全電池在不同比電流下獲得的GCD曲線。(d) 倍率性能。(e) Cu-Cl2全電池在20 A g?1下的長期穩定性。
▲正極CV曲線顯示正電極氧化還原電位約為1.1 V (vs. SCE),對應于Cl?/Cl2反應。負電極電位顯示兩個氧化還原對,分別位于約?0.28和0.36V (vs. SCE),分別與Cu+/Cu0和Cu2+/Cu+反應相關。根據這些電位差異,預計全電池將產生大約1.4和0.7 V的兩個充放電平臺。充放電曲線驗證了全電池的性能,展示了約1.3V的高放電平臺,良好的倍率性能和出色的循環穩定性。
研究總結
本文深入研究了氯配位對銅氧化還原電位的影響,以獲得高壓水系銅基電池。由于其與Cu+的絡合,Cl?可以穩定水系電解質中的Cu+,使得Cu+/Cu0的氧化還原反應能夠在比常規Cu2+/Cu0反應低約0.3V的電位下發生。與水配位相比,氯配位下的銅負極在10 mA cm?2下也表現出更高的面積容量、更快的氧化還原動力學和更高的循環穩定性,在20 mA cm-2下循環5000次后容量保持率達到99%。
最后,采用Cl?/Cl2作為正極反應原位構建了Cu-Cl2全電池。該電池提供了1.3 V的高放電平臺,并且在5 A g?1下具有162mAh g?1的放電容量(基于科琴黑的質量)。它還表現出出色的倍率性能和良好的循環穩定性,在10000次循環后仍保留了77.4%的初始容量。本研究中使用的策略——調節配位環境——降低了負極電位,改善了電化學動力學,并增強了循環穩定性。這些發現可以為高性能水系電池的未來發展提供線索。
審核編輯:劉清
-
電池電壓
+關注
關注
0文章
197瀏覽量
11879 -
電解質
+關注
關注
6文章
821瀏覽量
20445 -
電解液
+關注
關注
10文章
859瀏覽量
23356 -
光譜儀
+關注
關注
2文章
1015瀏覽量
31265 -
XPS
+關注
關注
0文章
97瀏覽量
12155
原文標題:港城大支春義/南科大李洪飛/深大劉卓鑫NC:優化配位環境提高水系銅-氯電池電壓
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
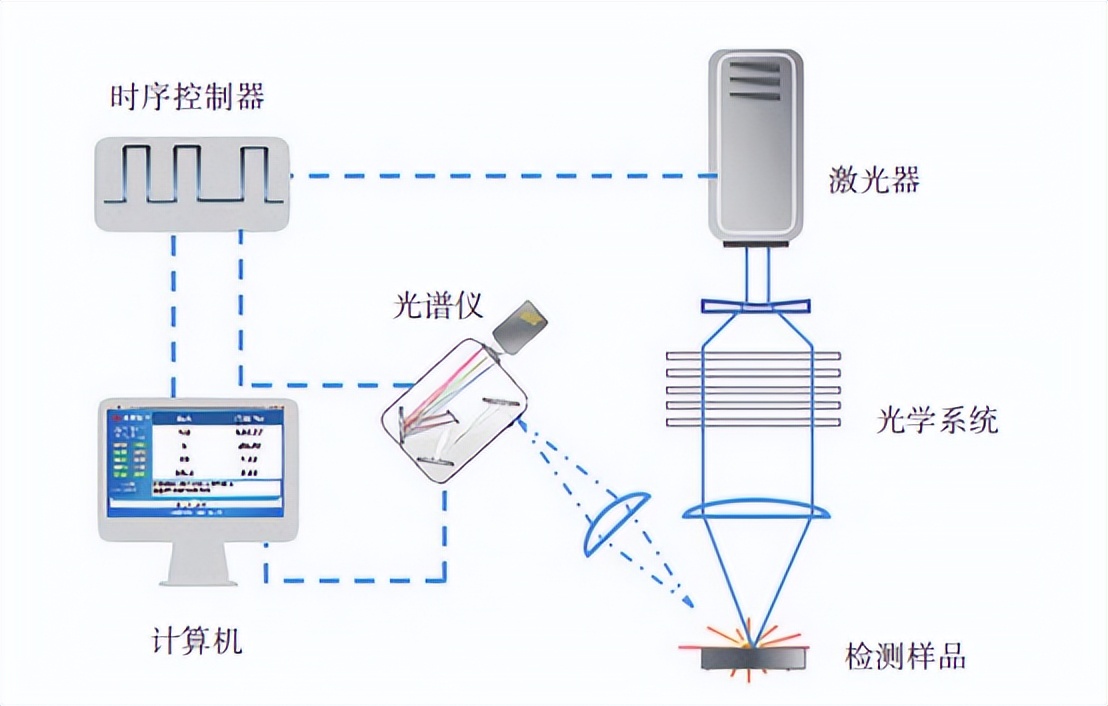
基于激光誘導擊穿光譜的銅物料快速檢測方法
水系電池金屬負極腐蝕問題綜述
一種高能量密度水系有機液流電池

焊接技術流程優化方法
PCB設計中填充銅和網格銅有什么區別?
如何提高信噪比的有效方法
PCB設計中填充銅和網格銅有什么區別?
如何優化MEMS設計以提高性能
堿錳電池的銅針表面怎么處理
優化汽車類48V電池和電動自行車應用中的線路電壓和負載調節

BQ76952在電池均衡時電壓采樣不準確的原因分析及優化方法





















評論