液滴微流控方法的出現極大地提高了單細胞測序的通量,然而新的問題也在不斷地涌現,例如在處理復雜樣品或多樣品時,往往可能伴隨著很多干擾因素,例如細胞碎片、雜質、空液滴等,針對這些問題需要額外的方法進行處理優化,不僅影響測序工作效率,同時進行過多的處理還會影響細胞活性,最終導致總體RNA捕獲效率較低。因此,現階段的研究方向之一就是優化分選獲得單細胞的步驟,盡可能獲得單細胞中全部的mRNA。
近期,Sarah A. Teichmann和Florian Hollfelder團隊在Nature Communications期刊上發表了一篇題為“spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content”的研究論文,提出了一種基于液滴微流控平臺且最大限度地提高單細胞測序信息內容的新方法。
SpinDrop是一種可擴展的液滴微流控方法,能以較低的成本對單個活細胞、完整細胞核、多聚甲醛固定樣本或靶細胞類型進行高靈敏度的3’ mRNA測序。
該方案的新穎點有兩個方面,其一是采用熒光激活液滴分選蛋白(FADS)標記細胞來專門分選提取目標細胞(圖1B、1C),其二是采用多步驟加酶和微注射(Picoinjection)技術向液滴中加入了逆轉錄酶(圖1D)。
實驗證明,與inDrop單細胞測序方法相比,該研究提出的基因檢測率提高了5倍,與10x Chromium平臺相持平,同時顯著降低了與空液滴和質量差的細胞相關所造成的噪音。
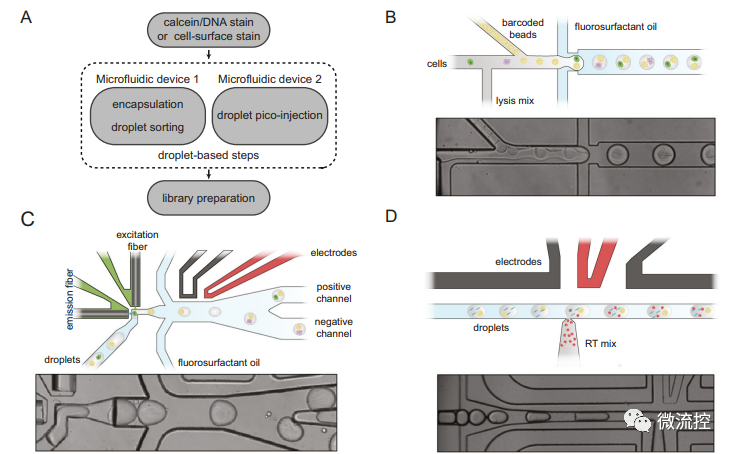
圖1 spinDrop的模塊化液滴微流控工作流程概述
FADS法分選單個活細胞
針對采用FADS方法分選單個活細胞的可行性,該文章進行了多個實驗驗證。
為證明FADS方法富集含有單個細胞液滴的能力,研究人員使用Calcein-AM染液對HEK293T細胞進行染色,設定細胞熒光信號的閾值,通過FADS方法分選富集(只分選不裂解細胞),發現含有單個活細胞的液滴富集程度高達96.1%(圖2B)。
為進一步驗證FADS方法的潛力,研究人員將測試細胞修改為1:1比例的死和活的HEK293T細胞,對混合的死細胞和活細胞進行分選,結果顯示,在熒光顯微鏡下,含有細胞的液滴池中,活細胞的豐度顯著提高了19倍。84.8%的液滴含有單個活細胞,超過了未經分選的預測值4.52%。
該研究還對丟棄空液滴是否會導致空液滴產生的背景噪聲讀數比例更低(圖2D)以及測試使用FADS方法富集特定類型細胞的能力(圖2C、2E、2F)進行了實驗論證,并取得了較為理想的結果。驗證了FADS法分選單個活細胞可行性。
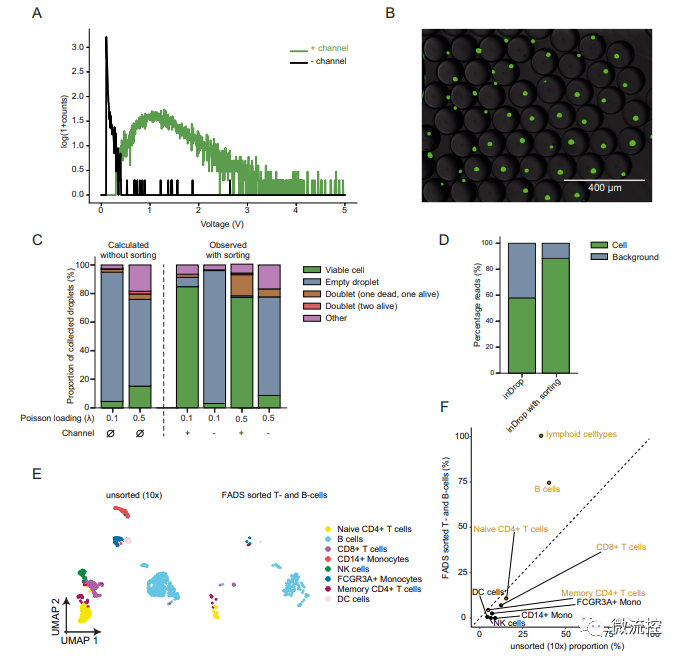
圖2 利用FADS方法分選單個活細胞可降低空液滴和死細胞的背景噪聲
多步驟加酶和微注射技術向液滴中加入逆轉錄酶
該論文指出采用熱變性和蛋白酶K方法裂解細胞可以增加RNA產量,但與逆轉錄酶的工作溫度不兼容,且液滴內容物含量在封裝后不能再被調節,這就妨礙了在逆轉錄之前進行有效的細胞裂解,因此提出通過在液滴封裝階段就加入裂解液進行裂解,然后再通過微注射步驟將改進的逆轉錄混合酶注射到液滴后進行逆轉錄的方法,將裂解和逆轉錄兩步驟分開進行。在不影響逆轉錄的前提下,該方法可以實現對細胞更為充分的裂解,從而捕獲更多的RNA。
在用酶方面,該研究采用蛋白酶K對細胞進行裂解和熱變性處理可以使基因檢出率提高了三倍以上,同時使用Superscript III RT酶進行逆轉錄,使得最終檢測到的基因高于其他用酶配方(圖3A)。
該研究還將spinDrop與10x Chromium和inDrop的基因檢測靈敏度進行了比較,結果表明,spinDrop檢測到的基因中位數遠大于inDrop,略高于10x Chromium(圖3B)。
此外,該研究還對spinDrop方法的可重復性進行了測試(圖3C、3D),并對spinDrop方法在微注射步驟中分隔單細胞并防止液滴合并的有效性(圖4E),以及采用spinDrop方法檢測多聚甲醛固定的細胞樣品的可行性進行了驗證(圖3F),以上驗證實驗最終都取得了理想的結果。
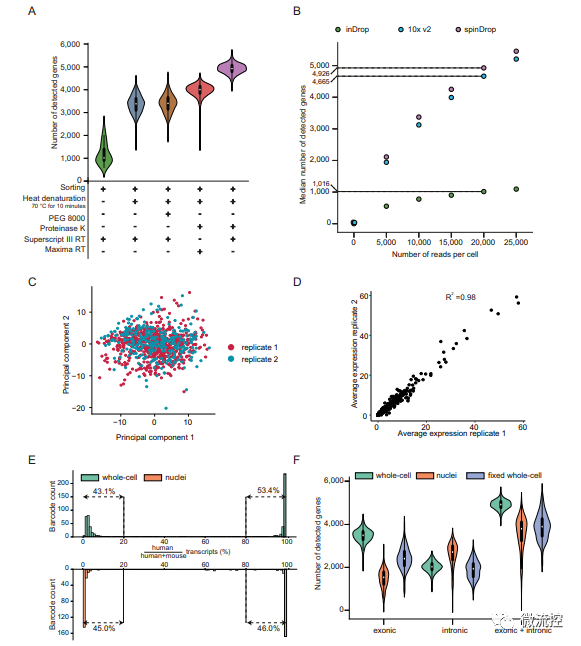
圖3 改進的逆轉錄混合酶和微注射混合酶后提高RNA捕獲效率
研究人員后續還對高度受損的胚胎小鼠大腦樣本進行了分析,以驗證spinDrop是否可以用于提高低活力生物樣品的轉錄組學質量(圖4),并通過采用scEU-seq中的代謝標記方法標記新生RNA,驗證了spinDrop平臺高通量揭示小鼠器官發生過程的可行性(圖5),從而進一步驗證了spinDrop在基因測序方面的優勢。
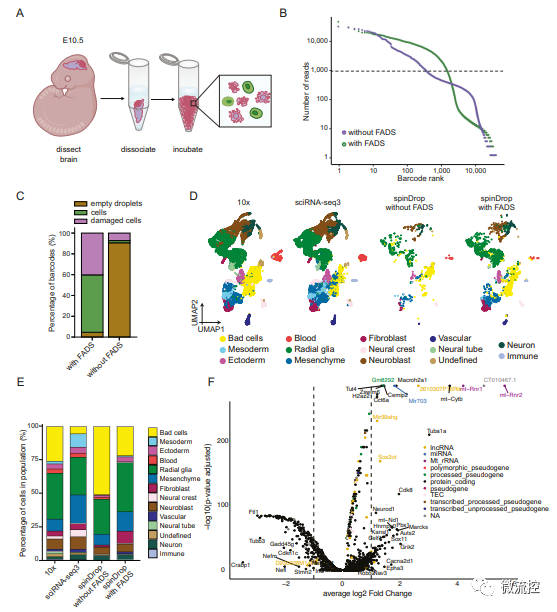
圖4 使用spinDrop方法生成的發育階段E10.5胚胎小鼠大腦的轉錄圖譜 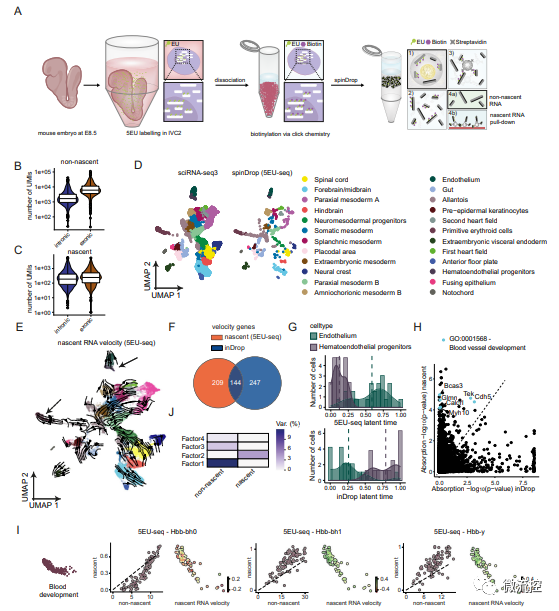
圖5 使用5EU-seq標記新生RNA經spinDrop測序后生成的小鼠器官發生過程中的轉錄動力學
總而言之,spinDrop技術建立在inDrop基礎上,且與之相比有很大的進步,與常見的10x Chromium平臺相比也有一定優勢,具備10x Chromium平臺所不具備的能力,例如進行新生RNA測序和器官生發過程的揭示。基于液滴微流控的spinDrop單細胞測序法旨在從少量樣品中高靈敏度的獲取單細胞全部的RNA并建立文庫,同時將受損細胞和空液滴所造成的背景噪聲降至最低,做出更為準確的結果。
審核編輯:劉清
-
RNA
+關注
關注
0文章
46瀏覽量
9715 -
微流控系統
+關注
關注
1文章
76瀏覽量
1871 -
微流控器件
+關注
關注
0文章
40瀏覽量
3189
原文標題:基于液滴微流控的"spinDrop"單細胞測序法,可提升mRNA捕獲效率
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 基于液滴微流控的單細胞測序法可提升mRNA捕獲效率
基于液滴微流控的單細胞測序法可提升mRNA捕獲效率











評論