【研究背景】
電解液溶劑化結構化學最近引起了電池領域研究者的極大關注,其主要原因是傳統認為的通過電解液在電極表面分解形成的固體電解質界面膜(SEI)并非穩定電極及電池性能的唯一主導因素。這一觀點雖然已經通過循環的石墨、合金、金屬負極以及多數正極在“電解液交換實驗”中得到證明,但是并不能驗證SEI膜在某些方面可能的積極作用。
因此,如何區分電解液溶劑化結構及其界面模型與SEI對電極及電池性能的影響仍具挑戰。尤其將成膜添加劑引入電解液中時,該問題變得更加復雜,因為添加劑有可能形成SEI,亦有可能改變電解液溶劑化結構,然其各自的作用極難以辨別和區分。
針對上述問題,本研究以銻(Sb)負極為例,設計了一款新的二乙二醇二甲醚(DME)基電解液,詳細闡述了溶劑化結構及其衍生的界面模型和SEI對電極性能的影響,尤其對添加劑在電解液體相、電極界面以及SEI成膜過程中的作用進行了詳盡解析。
近期,中科院長春應化所明軍,蘭州大學張俊麗,以及韓國漢陽大學Yang-Kook Sun闡明了電解液組分(溶劑、鋰鹽、濃度、添加劑等)從溶劑化結構、界面模型到 SEI 成膜過程中的分子、離子行為以及各自產生的作用,發現了獨特的溶劑化結構衍生的界面模型和SEI均是穩定Sb負極的關鍵。
其中,添加劑(二氟草酸硼酸鋰,LiDFOB)不但能削弱Li+-DME之間的相互作用,而且參與形成的特定的SEI膜能夠有效削弱電極給電子的能力,進而提高電解液及電極穩定性。
【內容表述】
1.研究主旨
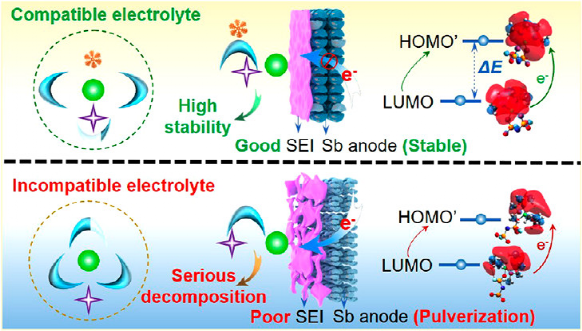
圖1. 溶劑化結構衍生的界面模型和SEI對電極的影響。
本研究以Sb負極例,詳細研究了溶劑化結構衍生的界面模型和SEI對電極穩定性的影響(圖1)。
2.電化學性能表征
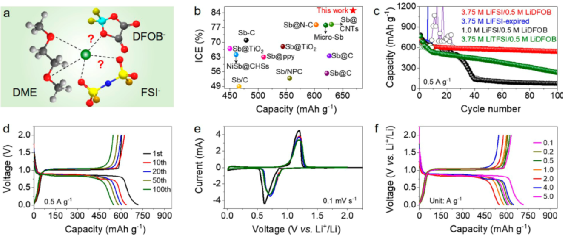
圖2. 微米Sb負極電化學性能。
本研究設計了一款以LiFSI鋰鹽,DME溶劑,LiDFOB添加劑的電解液(即3.75 M LiFSI/0.5 M LiDFOB in DME),用以穩定微米Sb負極,在該電解液中表現出656 mAh/g的容量及87.5%的首效,優于之前報道的工作(圖2a, b)。0.5 A/g電流密度下,100次循環后容量保持率88.6%,表現出優異的電化學性能。
相比之下,在沒有LiDFOB添加劑的3.75 M LiFSI in DME電解液中,微米Sb負極在幾個循環后就無法再正常充電。將電解液濃度降低至1.0 M(即1.0 M LiFSI/0.5 M LiDFOB in DME)時,微米Sb負極容量急劇下降,約40次循環后容量僅剩~130 mAh/g。
此外,使用LiTFSI鋰鹽(3.75 M LiTFSI/0.5 M LiDFOB in DME),Sb負極容量也大幅衰減,容量由初始的626 mAh/g經100次循環后降至229 mAh/g。以上結果表明,電解液的組分(如鋰鹽、溶劑、濃度、添加劑)均會影響微米Sb負極性能。
3.電極及SEI膜的表征
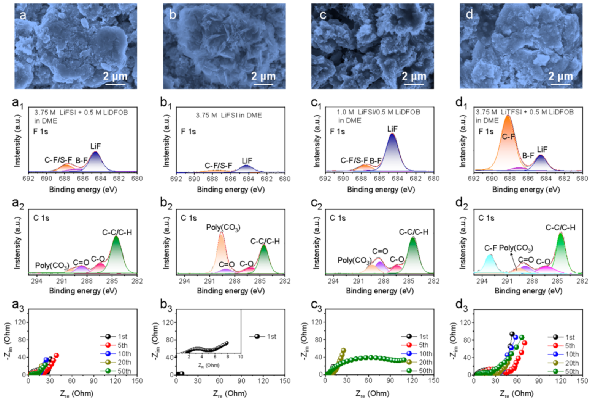
圖3. 電極及SEI膜的表征。
為確定不同電解液對微米Sb負極影響的原因,研究者對循環后的微米Sb負極進行了相關表征(圖3)。
結果表明,(1)3.75 M LiFSI/0.5 M LiDFOB in DME電解液中循環后的微米Sb負極表面的SEI比較光滑,且電極粉化程度最小,證明了高濃度和添加劑是維持微米Sb負極穩定的必要條件;(2)從F1s和C1s譜圖可以看出,3.75 M LiFSI/0.5 M LiDFOB in DME電解液中,微米Sb負極表面形成了一層以LiF為主導(LiF/含F有機化合物,2.74)且C含量少的SEI,表明在該電解液中,DFOB-的分解量有限,生成的SEI穩定,能有效抑制溶劑的分解;(3)3.75 M LiFSI/0.5 M LiDFOB in DME電解液中循環后微米Sb負極的電荷轉移電阻僅為4.11 Ω,這有利于Li+在電極中的擴散。
4.SEI膜作用分析
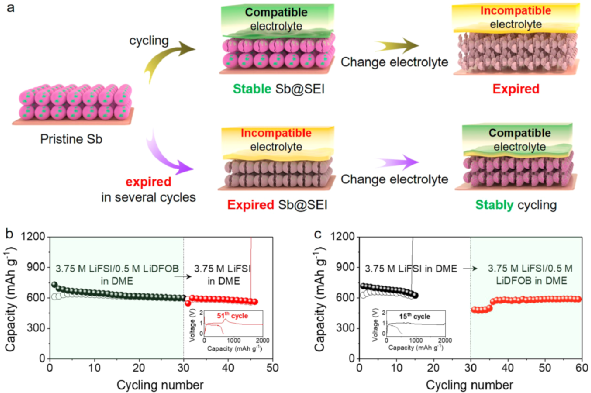
圖4. 電解液交換實驗。
盡管圖3中對SEI的表征結果看似可以解釋圖2c中微米Sb負極不同的電化學性能,但對SEI的分析仍不能全面地解釋電解液交換實驗中電極性能的不同。具體的交換實驗如圖4a和b所示。首先,讓微米Sb負極在兼容電解液(即3.75 M LiFSI/0.5 M LiDFOB in DME)中循環30次,以此在電極表面形成穩定的SEI(Sb@SEI);然后,拆開電池,使用Sb@SEI負極重新組裝電池,使用不兼容電解液(即3.75 M LiFSI in DME)繼續循環。
從圖4c可以發現,在不兼容電解液中,Sb@SEI負極能夠維持14次循環,在第15次循環過程中失效。以上結果表明,如果電解液不能兼容微米Sb負極,即便在兼容電解液中生成的SEI可以起到保護微米Sb負極的作用,但作用有限,不能在長循環中持續穩定負極。
相反地,首先讓微米Sb負極在不兼容電解液(即3.75 M LiFSI in DME)循環,直到其不能正常工作,得到在差的SEI包覆的微米Sb負極(Sb@SEI);然后,拆開電池,使用Sb@SEI負極重新組裝電池,使用兼容電解液(即3.75 M/0.5 M LiDFOB LiFSI in DME)繼續循環。從圖4d可以觀察到,Sb@SEI負極經過5次循環后可恢復初始的容量,并能維持良好的循環穩定性。以上結果表明,微米Sb負極失效的原因可能是電解液的不兼容。
5.體相電解液性質表征
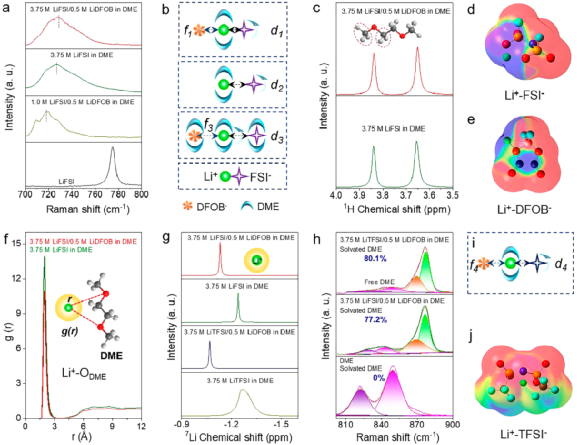
圖5. 電解液表征。
因此,本研究將重點從分子層面上構連電解液組分與電池性能之間的關系。通過拉曼光譜、液相核磁共振譜等測試分析了不同電解液中的Li+、溶劑、添加劑之間的相互作用,以明晰不同電解液中Li+溶劑化結構的差異(圖5)。拉曼結果表明,通過提高鋰鹽濃度(如將電解液濃度從1.0 M提高到3.75 M)或引入LiDFOB添加劑可以顯著降低S-N-S的紅移程度。
這主要是因為隨著鋰鹽濃度的提高或添加劑的引入,參與溶劑化的DME數量逐漸不足。換句話就是,紅移程度越小,Li+-FSI-的相互作用越強,即3.75 M LiFSI/0.5 M LiDFOB in DME電解液中Li+-FSI-的相互作用最強(圖5a, b)。在1H核磁共振譜中,DME溶劑分子中的-CH2/-CH3基團的化學位移進一步證明了引入LiDFOB添加劑能增強Li+-FSI-的相互作用(圖5c)。當LiDFOB引入3.75 M LiFSI in DME電解液中,1H核磁共振譜中對DME中-CH2/-CH3基團的屏蔽作用會增大。
這主要是因為LiDFOB也需要DME溶劑參與解離,導致溶劑化結構中DME溶劑分子數量不夠,在一定程度上減弱了Li+-DME的相互作用。這一觀點通過徑向分布函數計算結果得到了進一步證明(圖5f)。此外,通過7Li核磁共振譜進一步證實了LiDFOB添加劑對Li+溶劑化結構的影響。
如圖5g所示,將LiDFOB引入3.75 M LiFSI in DME電解液中后,7Li核磁共振譜的化學位移向低場偏移表明溶劑對Li+的屏蔽作用降低,這主要是由于DME溶劑數量不足和DFOB-在Li+周圍頻率出現增大引起的。這些有力的證據表明,LiDFOB除了眾所周知的成膜功能外,還能參與Li+溶劑化結構。
6.溶劑化結構及其界面模型
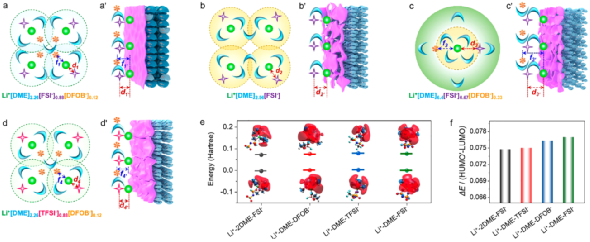
圖6. Li+溶劑化結構及界面模型。
根據Li+在不同電解液中與溶劑、陰離子之間的相互作用,建立了Li+溶劑化結構及其衍生的界面模型。其中,電解液以其結構化單元Li+[solvent]x[anion]來表示。此外FSI-和Li+之間的相對距離(即d')以及DFOB-和Li+之間的相對距離(即f')用于定性描述Li+去溶劑化過程中微米Sb負極表面Li+-FSI-和Li+-DFOB-相互作用強度,距離越長,則代表相互作用越弱。
此外,用最低的未占用分子軌道(LUMO)和獲得一個額外的電子時,相應軌道變為HOMO'的能量差(ΔE)來評估電解液的穩定性。其中,較小的能量差異表示軌道之間的相似性,導致電子傳輸所需要的能量越低,說明了Li+-solvent-anion復合物穩定性越弱,即電解液也不穩定。
在3.75 M LiFSI/0.5 M LiDFOB in DME (Li+[DME]2.26[FSI-]0.88[DFOB-]0.12)電解液中,由于DME溶劑不足,不足以將Li+、FSI-和DFOB-充分溶劑化,Li+第一溶劑化層會共享溶劑而相互重疊。由于Li+-FSI-和Li+-DFOB-的相互作用較Li+-DME強,FSI-和DFOB-會出現在第一溶劑化層中的Li+周圍,削弱Li+與DME之間的相互作用,進而降低DME溶劑分子的極化。在去溶劑化過程中,可以在微米Sb負極表面形成以陰離子為主的電解液分解,有效抑制了溶劑的分解,提高了電解液及微米Sb負極的穩定性(圖6a)。
此外,理論模擬得到,Li+-DME-DFOB-配合物的ΔE(0.0750 Hartte)略小于Li+-DME-FSI-配合物的(0.0770 Hartte)(圖6f)。這說明,Li+-DME-DFOB-配合物更容易接收電極上的電子,并在電極表面還原形成SEI。隨后,陰離子主導分解形成的SEI會削弱電極對Li+-DME-DFOB-或Li+-DME-FSI-配合物的供電子能力,提高了電解液的穩定性。基于上述對電解液穩定性的分析,成功地闡明了微米Sb負極的優異性能的原因。
相比之下,在3.75 M LiFSI in DME (Li+[DME]2.56[FSI-])電解液中,由于沒有LiDFOB分散DME溶劑參與解離溶劑化,參與解離溶劑化LiFSI的DME溶劑分子數量增多,第一溶劑化層重疊的程度較有添加劑的減少。換言之,Li+-FSI-的相對距離(d2)略長于Li+[DME]2.26[FSI-]0.88[DFOB-]0.12中Li+-FSI-的相對距離(d1,d1 < d2)。
同樣的,在圖6b'的界面模型中Li+與FSI-之間的相對距離(d2')也相對遠一些,即d2' > d1'。在去溶劑化過程中,FSI-雖然也會優先接收電極上的電子參與形成SEI,但與DFOB-衍生的SEI膜相比,FSI-誘導生成的SEI膜并不穩定,不足以有效的削弱電極的供電子能力。
這樣會導致Li+-DME或Li+-2DME-FSI-配合物可以繼續得到電子發生分解,造成SEI中C含量的增加,在電極表面形成富C和F有機物的SEI。以上因素共同影響,使得微米Sb負極在幾次循環后就不能正常工作。在Li+[DME]9.6[FSI-]0.88[DFOB-]0.12電解液中進一步證實了LiDFOB添加劑的作用。當LiFSI濃度降低到1.0 M時,由于參與溶劑化的DME溶劑分子數量足夠多,Li+溶劑化結構(d3,f3)和界面模型(d3',f3')中Li+和FSI-、DFOB-的相對距離最長(圖6c,c')。
此外,Li+-2DME-FSI-配合物的ΔE值為0.0745 Hartte,小于Li+-DME-FSI-配合物的0.0770 Hartte(圖6f),表明Li+[DME]9.6[FSI-]0.88[DFOB-]0.12電解液的穩定性相比高濃度電解液要差。在去溶劑化過程中,DFOB-和DME溶劑分子會很容易在電極表面得到從電極上傳遞的電子發生分解,在電極表面生成富B、C和F物質的SEI。
生成的SEI可以在一定程度上抑制電極的供電子能力,相對減少DME的分解,使得微米Sb負極可以維持基本的循環。然而,在Li+[DME]9.6[FSI-]0.88[DFOB-]0.12電解液中,由于DME溶劑能充分解離、溶劑化鋰鹽,DME溶劑分子被Li+的極化程度較高,會不能有效地抑制循環過程中電解液的分解,在電極表面生成富含大量有機物的SEI,導致電極阻抗逐漸變大。
以上結果進一步表明提高鋰鹽濃度和引入LiDFOB添加劑,可以提高電解液穩定性,改善電極性能。此外,選擇合適的陰離子對維持電解液的穩定性也很重要。如圖6d,d'所示,在Li+[DME]2.26[TFSI-]0.88[DFOB-]0.12電解液中,Li+溶劑化結構和界面模型中Li+-TFSI-(d4,d4')的相對距離與Li+[DME]2.26[FSI-]0.88[DFOB-]0.12電解液中的相對距離要遠一些,而Li+-DFOB-(f4,f4')的相對距離則相當。
在去溶劑化過程中,由于Li+-DME-DFOB-配合物較低的ΔE值,使得DFOB-更容易在電極表面發生分解,并形成富B和F物質的SEI。雖然生成的SEI能夠削弱電極的供電子能力,但由于Li+-DME-TFSI-配合物的ΔE值(0.0760 Hartte)低于Li+-DME-FSI-配合物的,且Li+對DME溶劑分子的極化程度相對較大,造成電解液的分解,最終導致電池容量的衰減。
以上研究結果表明,Li+溶劑化結構及其界面模型與SEI能有效地改善微米Sb負極電化學性能。其中SEI可以有效地降低電極的給電子能力,減少電解液的分解,進而提高電解液的穩定性。
7.鋰離子全電池應用
為了進一步驗證所設計電解液的優勢,組裝了以微米Sb為負極,LiFePO4做正極,3.75 M LiFSI/0.5 M LiDFOB in DME做電解液液的鋰離子全電池,如圖7所示。該電池在0.5C(1C = 150 mA/g)電流密度下表現出了良好的循環性能,經100次循環,容量保持在78.4 mAh/g,容量保持率為54%。
此外,在0.1、0.2、0.5、1、2和5C電流密度下,容量分別為155、151、141和126 mAh/g,表明了全電池具有優異的倍率性能。上述結果充分證明了微米Sb負極在3.75 M LiFSI/0.5 M LiDFOB in DME電解液中的高穩定性和可逆性。
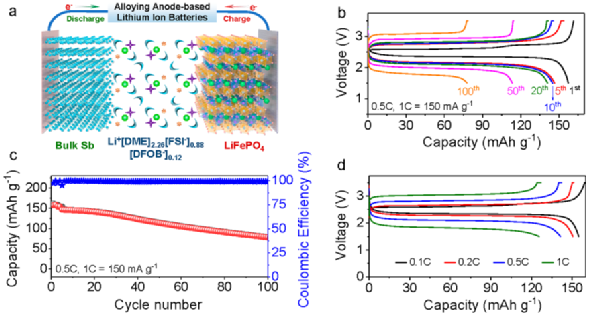
圖7. 全電池性能。
【結論】
該工作以微米Sb負極為研究對象,設計了一款新的基于DME的電解液,以認識溶劑化結構衍生的界面模型和SEI對電極性能的決定性影響。研究發現,鋰鹽濃度、種類和添加劑對于特定SEI和界面模型的形成都至關重要,最終影響電極的循環穩定性。尤其,該工作從溶劑化結構、界面模型到最終形成的SEI的動態演化過程全面闡述了電解液組分尤其添加劑的作用。該研究為通過調節溶劑化結構和SEI的協同方法設計電解液提供了指導。
審核編輯:劉清
-
電解液
+關注
關注
10文章
848瀏覽量
23126 -
固體電解質
+關注
關注
0文章
46瀏覽量
8395
原文標題:應化所明軍研究員電解液融合篇:溶劑化結構與SEI膜的是是非非
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
水系電解液寬電壓窗口設計助力超長壽命水系鈉離子電池
中國科大實現耦合高度可調的二維硅基量子點陣列




 設計一款新的二乙二醇二甲醚(DME)基電解液
設計一款新的二乙二醇二甲醚(DME)基電解液














評論