新冠病毒(SARS-CoV-2)具有高度傳染性,目前的檢測均基于實時逆轉錄PCR檢測技術,雖然效率高,但其技術要求高且價格昂貴,不適合資源相對稀缺的地區大規模使用。
據麥姆斯咨詢報道,江蘇省原子醫學研究所謝敏浩教授課題組基于CRISPR/Cas12a,開發了一種穩健且高靈敏度的電化學發光(ECL)生物傳感器平臺,用于檢測SARS-CoV-2 RdRp(RNA依賴性RNA聚合酶,簡稱RdRP)基因。相關研究內容發表在Chemical Engineering Journal上。
為了構建該生物傳感器平臺,研究人員在ECL生物傳感器電極表面修飾DNA四面體結構,DNA四面體可以與DNA1形成DNA三鏈復合物,在核酸擴增反應的初始狀態下,引入兩個發夾DNA(H1和H2),在存在核酸外切酶III(Exo III)的情況下,可以同步切割、釋放H1a和H2a。只有當H1a和H2a同時存在時,才能形成H1a/H2a雙鏈,從而激活CRISPR/Cas12a的活性,并允許CRISPR/Cas12a切割DNA1(圖1B)。如果反應體系中不存在目標物質,則無法形成H1a/H2a雙鏈,也無法激活CRISPR/Cas12a的活性并切割DNA1。其中體系中的DNA1與電極表面的DNA四面體結合將引起ECL信號的變化,特別的是,該生物傳感器平臺可以在pH=10時“再生”(圖1A),使其能夠持續長期使用,從而準確監測待測核酸濃度。
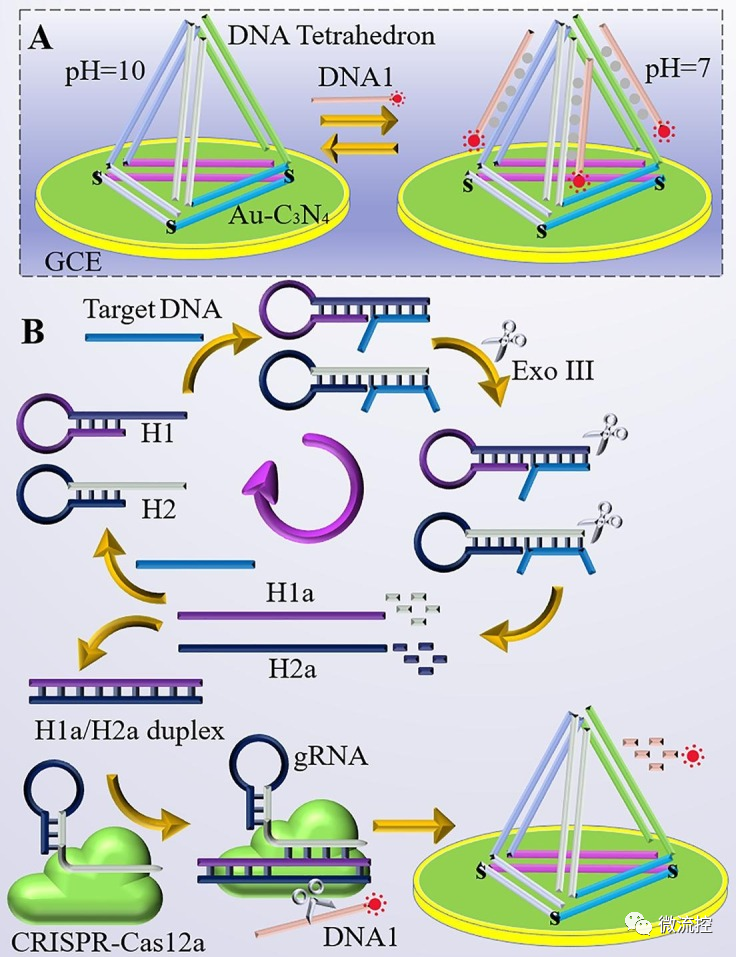
圖1 基于CRISPR/Cas12a反式活性測定SARS-CoV-2 RdRp基因的pH誘導再生生物傳感器示意圖
為了進一步研究該傳感器平臺的特征,研究人員首先通過透射電子顯微鏡(TEM)對合成的Au-g-C?N?進行表征,觀察到金納米粒子的直徑約為17nm,且均勻分散在C?N?納米片的表面(圖2A),此外還通過紫外表征發現合成的Au-g-C?N?將會在360nm和520nm之間有特征峰(圖2B),介于AuNPs(520nm)和g-C?N?(360nm)特征峰之間,并通過能量色散X射線光譜儀(EDX)進行元素分析(圖2C、D),均表明Au-g-C?N?成功合成;通過聚丙烯酰胺凝膠電泳(PAGE)表征DNA四面體的成功合成(圖2E)。
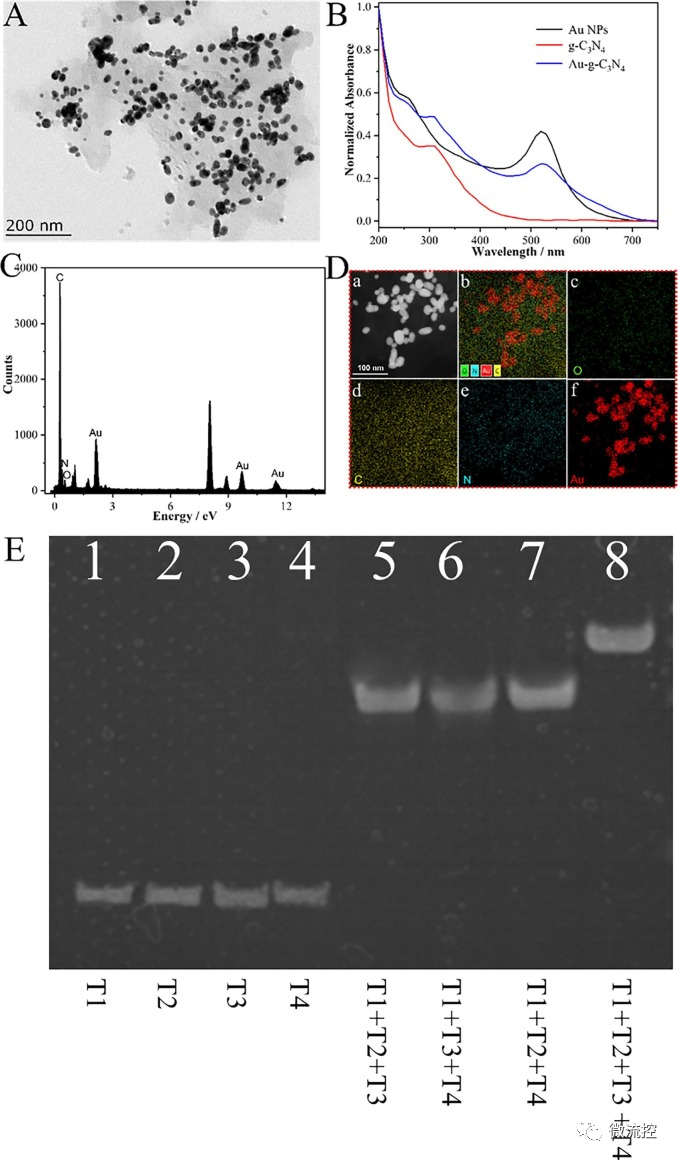
圖2 Au-g-C?N?和DNA四面體的表征
在本研究中,發光信號最初來源于g-C?N?,其可能的發光機理如下:g-C?N?在外加電壓下獲得一個電子,并轉化為g-C?N?(1);S?O?2?在外加電壓下獲得一個電子,并降低為SO?2?和SO??(2);SO??和g-C?N??之間發生電子轉移,并且g-C?N??在激發態下變成g-C?N?*(3);g-C?N?*的激發態完成了電子躍遷,并轉變為基態g-C?N?,同時在460nm處產生光(4)。
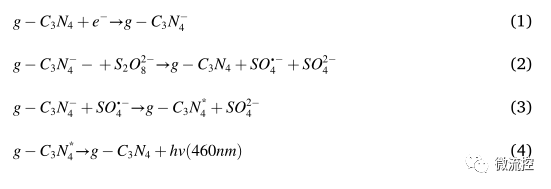
為進一步表征pH介導再生生物傳感器逐步修飾過程的電化學響應,研究人員采用了循環伏安法(CV)。裸玻碳(GCE)電極的CV曲線(曲線a)顯示了最大電流峰值。當Au-g-C?N?(曲線b)沉積在電極表面時,電流峰值顯著降低。當DNA四面體和6-巰基己醇(MCH)(曲線c)繼續在電極表面進行進一步修飾時,電流峰值繼續降低,表明不良導電物質吸附在電極表面,這與DNA四面體和MCH的絕緣性能一致。DNA1繼續通過四面體吸附在電極表面后,電流繼續減少(曲線d),導致電流峰值出現類似的減少。同時,通過圖3B所示的電化學阻抗譜(EIS)對pH介導再生生物傳感器的逐步構建過程進行了表征。電化學CV和EIS表征均證明成功合成了pH介導再生生物傳感器。研究人員發現60min為Exo III輔助擴增反應時間的最佳條件(圖3C),90min后三鏈核酸形成達到穩定(圖3D)。
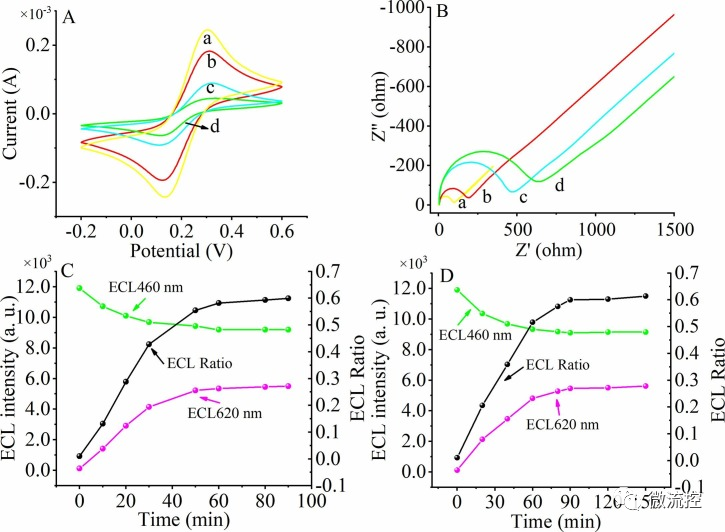
圖3 使用循環伏安法和電化學阻抗譜法表征生物傳感器的構造
最終將構建的比率ECL生物傳感器在優化條件下用于檢測SARS-CoV-2 RdRp基因。圖4A描繪了ECL信號隨SARS-CoV-2 RdRp基因濃度增加的變化。發現ECL(620nm)/ECL(420nm)的變化值也與ECL(620nm)/ECL(420nm)呈線性關系(圖4B):Y=6.466 × 10??X-0.034,R2=0.9950,其中Y是ECL(620nm)/ECL(420nm)的比值,X是RdRp基因的濃度,根據檢測極限(LOD)的計算公式:LOD=3σ/k,該生物傳感器的LOD為43.70aM。
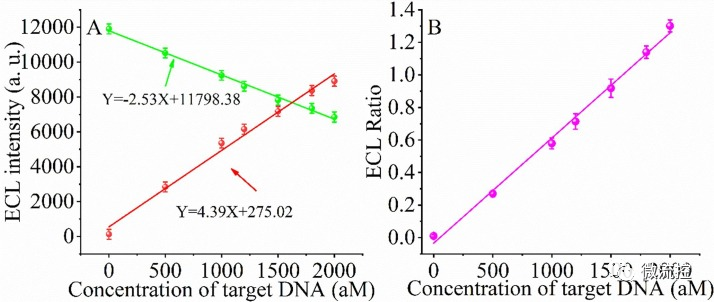
圖4 不同靶標DNA濃度下ECL及ECL(620nm)/ECL(420nm)信號的變化
將修飾后的電極浸入含有1pM SARS-CoV-2 RdRp基因的PBS中,連續掃描10個循環。ECL信號在460nm(圖5A)的相對標準偏差(RSD)為1.7%,ECL信號穩定在620nm(圖5B)時RSD為2.5%,這些實驗結果均表明該生物傳感器具備優異的穩定性。最后,研究人員研究了構建的生物傳感平臺在不同pH值下的pH介導再生。研究發現,當生物傳感器在TAE緩沖液(pH=10.0)中培養時,形成三鏈DNA的生物傳感器可以在該pH值下使得DNA從電極表面解離而再生(圖5D)。
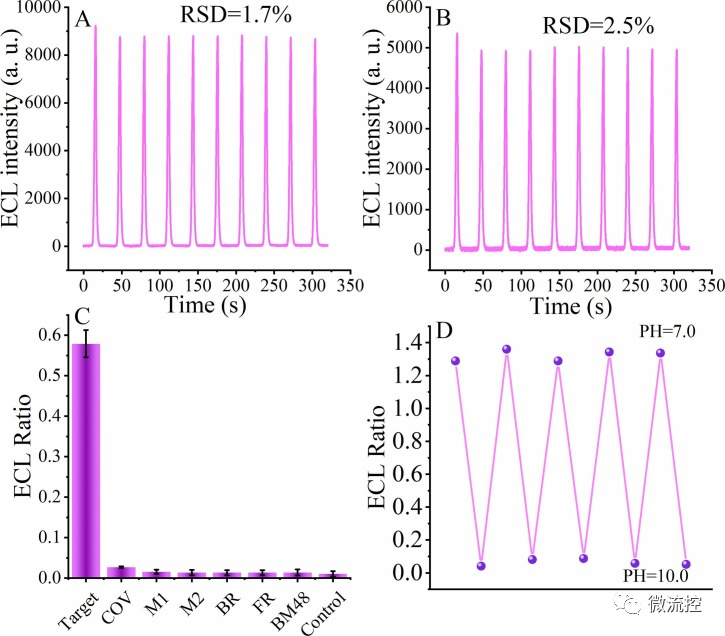
圖5 pH誘導的再生生物傳感器的穩定性和選擇性
總體來說,謝敏浩教授課題組提出的基于CRISPR/Cas12a的pH介導再生生物傳感器,其用于診斷SARS-CoV-2 RdRp基因的檢測靈敏度可達到43.70aM,具有臨床應用的潛力。
論文鏈接:
https://doi.org/10.1016/j.cej.2021.132472
審核編輯 :李倩
-
電化學
+關注
關注
1文章
329瀏覽量
20819 -
生物傳感器
+關注
關注
12文章
380瀏覽量
37642
原文標題:DNA四面體電化學發光生物傳感器平臺,用于新冠病毒檢測
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
新材料MOF助力提升生物傳感器性能
基于LMP91000在電化學傳感器電極故障檢測中的應用詳解
電化學氣體傳感器信號放大調試經驗
熱烈祝賀三郡科技電化學生物傳感電極芯片擴產能三億支
電化學傳感技術的革新之作: Sensirion 推出新一代甲醛傳感器 SFA40

力敏傳感器的靈敏度單位是什么
武漢大學:研究微流控電化學集成傳感器,快速、高效分離和靈敏檢測致病菌
電化學生物傳感器在生物檢測領域的顯著優勢
三郡科技:電化學生物傳感器電極與生物芯片的異同
便攜快速檢測的電化學生物傳感器:顛覆性變革生物檢測方式
車規芯片廠商泰硅微完成數千萬元戰略融資,溫度傳感器在各個行業中的應用




















評論