目前市場上鋰離子電池使用的多為石墨負極材料,從石墨的比容量和壓實密度看,負極材料的能量密度很難再得到提高。與石墨負極相比,硅基負極材料的能量密度優勢明顯。石墨的理論比容量為372mAh/g,而硅基負極材料的理論比容量超過其10倍,高達4200mAh/g。硅碳復合材料能夠大大提升單體電芯的比容量,增加電動汽車續航里程。
硅基負極材料也存在著較為明顯的缺點,主要有以下兩方面:其一是硅顆粒在脫嵌鋰時伴隨著體積膨脹和收縮而導致顆粒粉化、脫落,造成結構坍塌,最終導致電極活性物質與集流體脫離;其二是硅顆粒表面固體電解質層(SEI)的持續生長對電解液以及來自正極的鋰源的不可逆消耗。由于硅基負極材料的體積效應,硅在電解液中難以形成穩定的固體電解質界面膜。伴隨著電極結構的破壞,在暴露出的硅表面不斷形成新的SEI膜,加劇了硅的腐蝕和容量衰減。因此,為了提高硅基負極材料的電化學性能,系統研究電解液添加劑在硅負極表面的作用機理是十分必要和迫切的。
本文針對硅基負極材料的特點,研究不同成分電解液對硅負極表面成膜的影響及其作用機理,通過不同添加劑的配合使用提升硅碳負極的電化學性能。選用膨脹相對較小的氧化亞硅(SiO)混摻石墨作為負極材料,對SiO-C/Li扣式半電池進行充放電測試、成膜機理及形貌分析、NCM/SiO-C軟包電池常溫循環測試。
一、實驗
1.1 極片制作
正極:以鎳鈷錳(NCM)三元材料為正極材料,使用油系PVDF為正極粘結劑,導電劑使用Super-P, 使用吡咯烷酮(NMP)為溶劑,按照一定比例混合成正極電極漿料。
負極:以SiO混合石墨制成硅碳負極,使用水系SBR為負極粘結劑,導電劑使用Super-P,使用蒸餾水為溶劑,按照一定比例混合成負極電極漿料。
將正負極漿料分別均勻涂覆在鋁箔、銅箔表面上烘干,經過碾壓、裁切、烘干,制成實驗所需極片。
1.2 扣式電池制作
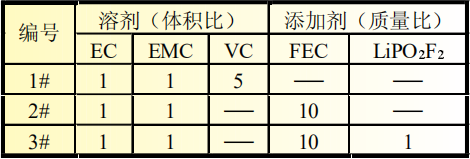
在充滿氬氣的手套箱中組裝SiO-C/Li半電池,其中金屬鋰片為電池級(上海產),滴入適量電解液,加入隔膜,制成扣式電池,型號為CR2032。電解液溶劑組分為EC∶EMC=1∶1,添加劑為VC、FEC、LiPO2F2(具體配比見表1)。
表1 三種電解液成分對比
1.3 軟包電池制作
以NCM極片為正極片,SiO質量分數為5%的SiO-C極片為負極片,極片經制片、卷繞、注液、預處理、鋁塑膜封口等,制作出軟包電池,標稱容量為4Ah。
1.4 性能測試
1.4.1 扣式電池測試
SiO-C/Li半電池:極片在恒溫真空干燥箱中干燥12h,于手套箱中組成正極半電池,電池型號為CR2032,在手套箱中封口取出,25℃常溫下靜置12h后待用。以0.05C恒流充放電進行容量標定。
1.4.2 成膜測試
SiO-C/Li扣式半電池以0.01C恒流放電, 截止電壓為0.005V,靜置10min。
1.4.3 循環測試
軟包電池循環測試流程:1C恒流充電至4.2V,恒壓充電至截止電流為0.005C,靜置10min,1C恒流放電至電壓降為3V,靜置10min,以此做充放電循環測試。
1.5 測試設備
容量和循環性能測試采用Arbin BT2000電池測試系統。用掃描電鏡對循環后硅碳負極片表面微觀形貌進行觀察,掃描電鏡為日本電子公司JSM-6360LV型。
二、結果與討論
2.1 添加劑對硅負極容量的影響
扣式電池采用三種電解液配方(電解液配方見表1)。測試電池電性能,不同電解液體系下扣式電池首次充放電比容量及首次庫侖效率對比見表2。
表2 三種電解液樣品電池充放電比容量對比
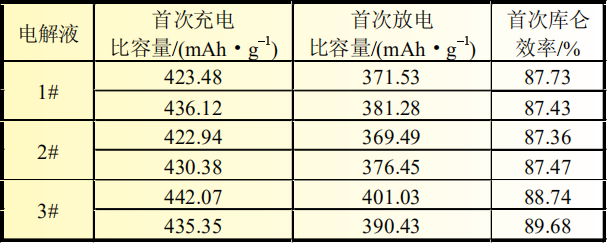
扣式半電池循環5次后,在手套箱中將其負極片取出,用流動的EMC進行沖洗,清洗后待EMC揮發完全后,將極片裝入自封袋中,進行后續硅碳負極形貌掃描。從表2硅碳負極放電比容量測試結果可以看出,加入5%的SiO可以有效提高負極比容量,3#電解液體系比容量可以達到395.73mAh/g,說明3#添加劑在負極片上成膜更為完全、致密,成膜阻抗更低,有利于降低不可逆容量損失。三種電解液首次庫侖效率排序如下:3#>1#>2#, 其中1#電解液和2#電解液對硅碳負極的比容量和首次庫侖效率影響差別不大。
圖1 不同電解液體系循環后硅碳負極表面形貌圖
圖1為不同電解液體系作用下硅碳負極表面形貌圖,圖中白色顆粒為SiO,灰色顆粒為石墨顆粒。從三張圖片中均可看出,當SiO-C/Li扣式半電池循環5次后,硅碳負極片表面已經明顯生成裂紋,這是由于在電化學循環過程中,鋰離子的嵌入和脫出會使硅材料體積發生膨脹與收縮,產生的機械作用力會使材料結構變化,甚至坍塌。因此,隨著循環的進行,硅顆粒周邊易形成縫隙,從形貌上來看,即表現為極片裂縫。這些裂痕的形成將造成極片表面SEI膜破裂, 電池循環壽命下降等問題。
2.2 添加劑成膜機理分析
使用SiO-C/Li扣式半電池以0.01C緩慢放電,并對放電曲線做微分,觀察電解液中添加劑在硅碳負極表面的成膜現象及作用機理,SiO-C體系0.01C放電曲線見圖2,放電曲線微分圖見圖3。
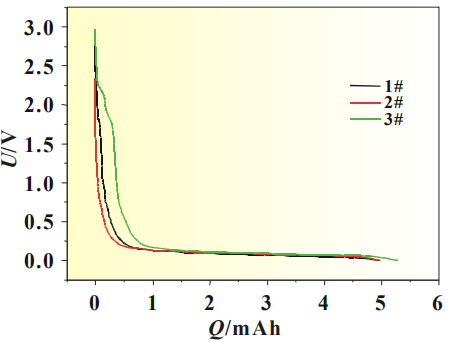
圖2 硅碳負極體系扣式電池0.01C放電曲線
從圖2中可以看出隨著放電的進行將存在一個微小的放電平臺,其中以3#曲線最為明顯,開始時間較早,說明添加劑在此處有成膜反應,但1#和2#電解液無法從放電曲線上對成膜電位進行準確判斷。圖3為SiO-C/Li扣式電池放電曲線的dQ/dV曲線,將放電曲線微分后,可以將電極表面 的成膜反應放大,便于分析添加劑作用機理,其中圖3(b)為圖3(a)中Y軸小量程放大圖。
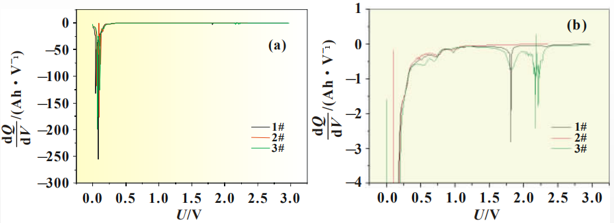
圖3 硅碳負極體系放電曲線微分圖
從圖3(b)中可以準確判斷成膜峰的位置及峰面積大小,三種添加劑成膜電位匯總為表3。結合圖3(b)和表3可以看出,LiPO2F2的成膜電位為2.4V,成膜反應開始最早,同時成膜峰與其他兩種電解液相比峰面積更大,主峰振幅的大小可以反映出成膜反應的強弱,說明此種添加劑組合成膜反應更完全、更致密,成膜能力更強。
表3 三種電解液成膜電位對比
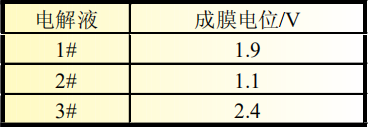
2#電解液中成膜添加劑為FEC,說明FEC的成膜電位為1.9V,在3#電解液中同樣含有同比例的FEC,在微分曲線中同一位置也可以明顯看到成膜峰,再次驗證了FEC在此位置可發生成膜反應。而1#電解液中的添加劑VC成膜最晚,成膜電位為1.1V,在硅碳負極體系中成膜能力最弱。對比三種電解液成膜電位可以看出,LiPO2F2最易在硅碳負極表面成膜,三種添加劑成膜能力排序為LiPO2F2>FEC>VC。由于電極表面所成SEI膜的質量直接關系到電池循環壽命, 因此從圖3的微分曲線所反應的成膜反應強弱可以對硅碳體系軟包電池循環效果進行預測。鑒于3#電解液成膜開始電位最早,成膜峰面積最大,因此推測3#電解液中LiPO2F2+FEC的添加劑組合在硅碳負極表面進行的成膜反應最完全、成膜最致密,電極表面SEI膜包覆良好,因此循環壽命更長。循環性能推測依次為含有FEC的2#電解液,以及1#電解液。
2.3 NCM/SiO-C軟包電池循環測試
NCM/SiO-C軟包電池進行1C恒流充放電測試,循環測試結果見圖4。從圖4中可以看出,3#電解液體系循環趨勢平穩,容量保持率較高,200次循環后容量保持率為90.29%,按此趨勢,循環壽命可達600次(80%容量剩余)。其次為2# 電解液,50次循環后即與3#呈現出較大差異,1#電解液循環趨勢下降更為明顯。
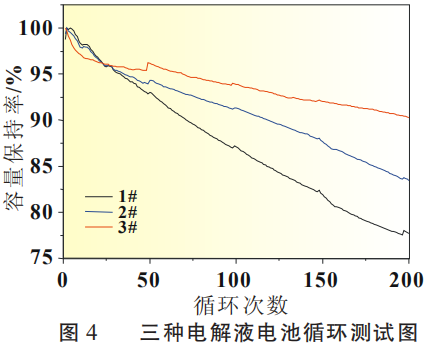
圖4 三種電解液電池循環測試圖
將圖4所展示的循環效果與圖3的電解液成膜機理分析相結合可以看出,本文從成膜反應強度預測出的循環效果與實測情況完全一致。因此,從添加劑成膜機理可對電池循環性能進行預測, 這也為電解液效果篩選提供了一種快捷有效的方法。同時,從圖4可以看出,電解液添加劑對于硅碳負極體系循環壽命有著顯著的影響,對于體系中成膜添加劑種類和用量的選擇仍需更為深入和系統的研究。
三、結論
本文針對硅碳負極材料的特性,考察了不同電解液組分在其表面的成膜作用及機理。通過對電池容量的標定可以看出,硅的加入可以有效地提高負極比容量,含有5%SiO負極實際比容量可以達到395.73mAh/g。LiPO2F2+FEC的添加劑組合可以將電池首次庫侖效率提高至89.21%,并且具有更強的成膜能力,可以顯著提高硅碳負極電池的循環壽命。隨著電動汽車市場的不斷發展,高能量密度的材料對提高電動車的續航里程起到絕定性的作用,硅基負極材料以其明顯的能量密 度優勢必將成為未來動力電池發展的重要方向,存在著巨大的應用潛力。
責任編輯:xj
原文標題:電解液添加劑在硅碳負極體系中作用機理研究
文章出處:【微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
-
電解液
+關注
關注
10文章
848瀏覽量
23126 -
電池
+關注
關注
84文章
10582瀏覽量
129794 -
硅碳負極
+關注
關注
0文章
10瀏覽量
5672
原文標題:電解液添加劑在硅碳負極體系中作用機理研究
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
水系電解液寬電壓窗口設計助力超長壽命水系鈉離子電池
電解電容正負極判斷 電解電容的作用是什么
貼片電解電容正負極判斷方法
鎳氫電池的電解液是什么
電解電容正負極接反了會有什么情況
弱溶劑化少層碳界面實現硬碳負極的高首效和穩定循環

鋰電池電解液如何影響電池質量?鋰電池電解液成分優勢是什么?
表面活性劑在電池材料中的應用




 不同成分電解液對硅負極表面成膜的影響及其作用機理
不同成分電解液對硅負極表面成膜的影響及其作用機理














評論